题目内容
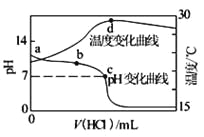
【题目】已知3.6g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质C(s)的燃烧热为Y kJ·mol-1,则1 mol C(s)与O2(g)反应生成CO(g)的反应热ΔH为( )
A. -Y kJ·mol-1 B. -(5X-0.5Y)kJ·mol-1
C. -(10X-Y)kJ·mol-1 D. +(10X-Y)kJ·mol-1
【答案】B
【解析】碳在氧气中燃烧,氧气不足发生反应2C+O2![]() 2CO,氧气足量发生反应C+O2
2CO,氧气足量发生反应C+O2![]() CO2,3.6g碳的物质的量为
CO2,3.6g碳的物质的量为![]() =0.3mol,6.4g的氧气的物质的量为
=0.3mol,6.4g的氧气的物质的量为![]() =0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生,令生成的CO为xmol,CO2为ymol,根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1,单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,所以生成0.2molCO放出的热量为XkJ-0.1YkJ,由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-
=0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生,令生成的CO为xmol,CO2为ymol,根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1,单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,所以生成0.2molCO放出的热量为XkJ-0.1YkJ,由于碳燃烧为放热反应,所以反应热△H的符号为“-”,故1mol C与O2反应生成CO的反应热△H=-![]() =-(5X-0.5Y)kJ/mol,故选B。
=-(5X-0.5Y)kJ/mol,故选B。

【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如图所示的反应关系。下列物质组不满足上述转化关系的是( )
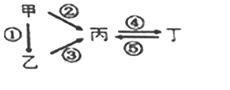
选项 | 甲 | 乙 | 丙 | 丁 |
A | N2 | NH3 | NO | NO2 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | S | H2S | SO3 | H2SO4 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. AB. BC. CD. D
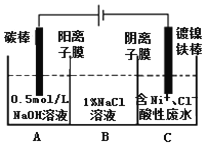
【题目】为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
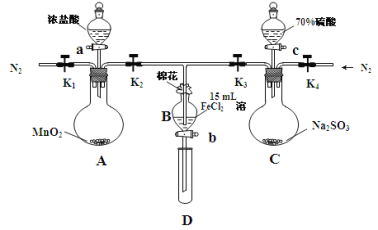
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_______________________________________________。
(2)棉花中浸润的溶液化学式为_________________________。
(3)A中发生反应的化学方程式为____________________________________。
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为___________和__________。
确定有Fe3+ 和Fe2+现象分别是_______________和____________________。
(5)过程Ⅵ,检验B溶液中是否含有SO42—的操作是_____________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO |
乙 | 既有Fe3+又有Fe2+ | 有SO |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
Cl2 > Fe3+ > SO2的是________(填“甲”“乙”“丙”)。