题目内容
【题目】下列各组离子在指定的溶液中能大量共存的是
A. 在透明溶液中:Cu2+、Mg2+、SO42-、Cl-
B. 加入铝粉产生H2的溶液中:Ba2+、Fe2+、HCO3-、NO3-
C. NaAlO2溶液中:Cu2+、Al3+、Cl-、CO32-
D. 常温下AG=lg![]() =12的溶液中:Na+、K+、S2O32-、SO42-
=12的溶液中:Na+、K+、S2O32-、SO42-
【答案】A
【解析】A.根据四种离子之间是否反应分析判断;B、根据加入铝片能产生氢气的溶液为酸性或者碱性溶液分析判断;C. 根据NaAlO2溶液中存在大量AlO2-,结合离子之间是否反应分析判断;D. 根据常温下AG=lg![]() =12的溶液显强酸分析判断。
=12的溶液显强酸分析判断。
A.Cu2+、SO42-、Mg2+、Cl-之间不发生反应,为澄清透明溶液,在溶液中能够大量共存,故A正确;B、加入铝片能产生氢气的溶液为酸性或者碱性溶液,碳酸氢根离子既能够与氢离子反应,也能够与氢氧根离子反应,在溶液中不能够大量共存,故B错误;C.NaAlO2溶液中存在大量AlO2-,能够与Al3+发生双水解反应,不能大量共存,故C错误;D.常温下AG=lg![]() =12的溶液显强酸,S2O32-在强酸溶液中发生歧化反应,不能大量存在,故D错误;故选A。
=12的溶液显强酸,S2O32-在强酸溶液中发生歧化反应,不能大量存在,故D错误;故选A。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_______________________________________________。
(2)棉花中浸润的溶液化学式为_________________________。
(3)A中发生反应的化学方程式为____________________________________。
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为___________和__________。
确定有Fe3+ 和Fe2+现象分别是_______________和____________________。
(5)过程Ⅵ,检验B溶液中是否含有SO42—的操作是_____________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO |
乙 | 既有Fe3+又有Fe2+ | 有SO |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
Cl2 > Fe3+ > SO2的是________(填“甲”“乙”“丙”)。
【题目】某化学小组采用如下装置用环己醇制备环己烯。
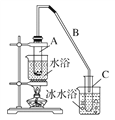
已知:环己醇和浓硫酸混合在85 ℃下制取环己烯。
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是____________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A. KMnO4溶液 B. 稀硫酸 C. Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________________________________。
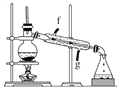
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____________。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是___________;如果得实际得到产品质量为8.2 g, 则该实验的产率是_________________(保留3位有效数字)。
a. 用酸性高锰酸钾溶液 b. 用金属钠 c. 测定沸点