题目内容
【题目】下列氧化还原反应方程式,所标电子转移方向与数目错误的是
A. 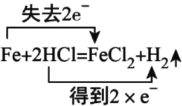
B. 
C. 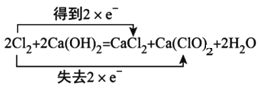
D. 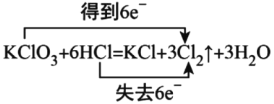
【答案】D
【解析】
A.在该反应中,Fe元素化合价由Fe单质的0价变为反应后FeCl2中的+2价,化合价升高,失去2e-;H元素的化合价由反应前HCl中的+1价变为反应后H2中的0价,化合价降低,得到2×e-,电子转移符合反应事实,选项A正确;
B.在该反应中,N元素化合价由NO的+2价变为反应后HNO3中的+5价,化合价升高,失去4×3e-;O元素的化合价由反应前O2中的0价变为反应后HNO3中的-2价,化合价降低,得到6×2e-,电子转移符合反应事实,选项B正确;
C.在该反应中,Cl元素化合价由Cl2的0价变为反应后Ca(ClO)2中的+1价,化合价升高,失去2×e-;Cl元素的化合价由反应前Cl2中的0价变为反应后CaCl2中的-1价,化合价降低,得到2×e-,电子转移符合反应事实,选项C正确;
D.在该反应中,Cl元素化合价由HCl的-1价变为反应后Cl2中的0价,化合价升高,失去5×e--;Cl元素的化合价由反应前KClO3中的+5价变为反应后Cl2中的0价,化合价降低,得到5e-,题目中反应过程中电子转移数目不符合反应事实,选项D错误;
故合理选项是D。

【题目】为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
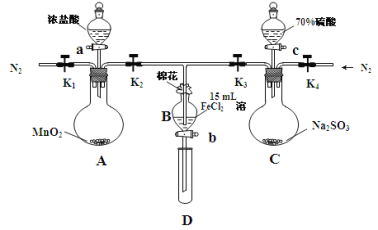
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_______________________________________________。
(2)棉花中浸润的溶液化学式为_________________________。
(3)A中发生反应的化学方程式为____________________________________。
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为___________和__________。
确定有Fe3+ 和Fe2+现象分别是_______________和____________________。
(5)过程Ⅵ,检验B溶液中是否含有SO42—的操作是_____________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO |
乙 | 既有Fe3+又有Fe2+ | 有SO |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
Cl2 > Fe3+ > SO2的是________(填“甲”“乙”“丙”)。
【题目】某化学小组采用如下装置用环己醇制备环己烯。
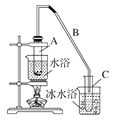
已知:环己醇和浓硫酸混合在85 ℃下制取环己烯。
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是____________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A. KMnO4溶液 B. 稀硫酸 C. Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________________________________。
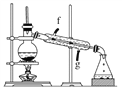
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____________。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是___________;如果得实际得到产品质量为8.2 g, 则该实验的产率是_________________(保留3位有效数字)。
a. 用酸性高锰酸钾溶液 b. 用金属钠 c. 测定沸点
【题目】(1)已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2 kJ ·mol-1;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0 kJ ·mol-1
Na(s) = Na(l) △H =2.6 kJ ·mol-1
请写出用液态钠与四氯化钛置换出钛的热化学方程式__________________________。
(2)已知:向一个体积恒定为2L的密闭容器中充入4mol A、1mol B,发生如下反应:4A(g)+B(s) ![]() 3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
①不能够说明该反应已达到平衡的是:________。
A.恒温下,容器内的压强不再变化
B.恒温下,容器内混合气体的密度不再变化
C.一定条件下,D的体积分数保持不变
D.一定条件下,单位时间内消耗4molA的同时生成1 mol B
②平衡后测得D的浓度为0.3mol·L-1,则从反应开始到平衡时,A的平均反应速率为________,B转化率为________。
(3)用活性炭还原法可以处理氮氧化物,有关反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
NO | N2 | CO2 | |
起始浓度/molL─1 | 0.10 | 0 | 0 |
平衡浓度/molL─1 | 0.04 | 0.03 | 0.03 |
①在t℃下,该反应的平衡常数为________(保留两位有效数字)。
②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,则该反应的
ΔH________0(填“>”、“<”或“=”),此时NO的转化率为________。