题目内容
【题目】肼(N2H4)是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l) △H=+267kJmol-1
N2(g)+H2O(l) △H=+267kJmol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJmol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=+534kJmol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJmol-1
【答案】D
【解析】
A.该反应为放热反应,焓变为负值,ΔH<0,A错误;
B.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,B错误;
C.该反应为放热反应,焓变为负值,ΔH<0,C错误;
D.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1,D正确;
故选D。

 阅读快车系列答案
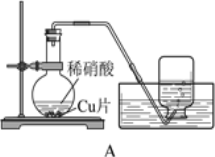
阅读快车系列答案【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。

(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入一段时间N2,关闭K1 | —— |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3-传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色, ;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量空气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
步骤II中,传感器记录数据如图所示:

(解释及结论)
(1)NO2与水反应的离子方程式为___。
(2)步骤I中,通入N2的目的是___。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:___。
(4)该实验验证NO2与水反应产物的实验证据包括___(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.NO3-传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果___。
【题目】下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
① | |||||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
② | ③ | ⑦ | |||||||||||||||
Fe | As | ||||||||||||||||
I、元素周期表是人们研究物质性质的重要工具。Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_______,当消耗1mol还原剂时,转移的电子个数为_______。
Ⅱ、A、B、C、D、E、X存在如下图转化关系〔部分生成物和反应条件略去〕。
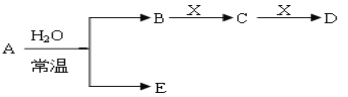
(1)假设E为氧化物,那么A与水反应的化学方程式为_______。
①当X是碱性盐溶液,C分子中有22个电子时,那么C的电子式为_______。
②表示
③当X为金属单质时,那么X与B的稀溶液反应生成C的离子反应方程式为_______。
(2)假设E为单质气体,D为白色沉淀,B含有的化学键类型为_______,C与X反应的离子方程式为_______。
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的要紧成分,1.6克该物质在氧气中完全燃烧放出热量31.2kJ,写出热化学方程式_______。
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用①和⑥组成的化合物和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式_______。
(5)元素②的单质在一定条件下,能与①的单质化合生成一种化合物,熔点为800℃。该化合物能与水反应放氢气,假设将1mol该化合物和1mol③形成的单质混合加入足量的水,充分反应后生成气体的体积是(标准状况下)_______。
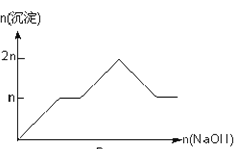
【题目】含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见表)
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
A. 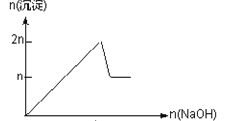
B. 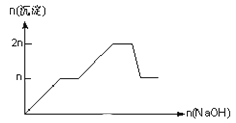
C. 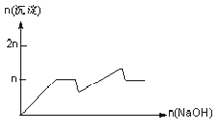
D.