题目内容
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)常温下0.1 mol·L-1的CH3COOH溶液,若升髙温度,上述4种表达式的数据增大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C. c(H+)·c(OH-) D.c(CH3COO-)·c(H+)/c(CH3COOH)
(3)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
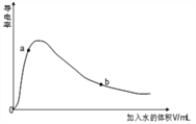
n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(4)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
【答案】CH3COOH>H2CO3>HC1O ABCD < > = ③④
【解析】
(1)酸电离平衡常数越大,酸电离程度越大,其酸性越强;
(2)由于弱电解质的电离过程是吸热过程,若该溶液升髙温度促进弱电解质电离平衡正向进行;
(3)醋酸为弱酸,加水促进电离;溶液的导电能力越强,溶液中的离子浓度越大;
(4)氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余.
(1)酸的电离平衡常数越大,该酸电离程度越大,其酸性越强,根据表中数据知,酸的电离程度大小顺序是CH3COOH>H2CO3>HClO>HCO3-,所以酸性强弱顺序是CH3COOH>H2CO3>HClO>HCO3-;
(2)若该溶液升髙温度,促进CH3COOH、H2O电离平衡正向进行,溶液中氢离子浓度、醋酸根离子浓度增大,所以A.氢离子浓度增大;B.c(H+)/c(CH3COOH)比值增大;C.溶液中c(H+)·c(OH-)之积为水的离子积,升温促进水电离,离子积常数增大;D.c(CH3COO-)c(H+)/c(CH3COOH)为平衡常数表达式升温促进电离平衡常数增大;
上述4种表达式的数据增大的是ABCD。
(3)醋酸为弱酸,加水促进电离,则n(H+):a<b,
溶液的导电能力越强,溶液中的离子浓度越大,则c(CH3COO-):a>b,
溶液稀释前后溶质的物质的量不变,则中和时消耗的氢氧化钠的物质的量相等;
(4)氢离子浓度相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余;
①由于反应过程中醋酸溶液中氢离子浓度大于盐酸溶液中氢离子浓度,则醋酸溶液反应较快,所以反应所需的时间A>B;故①错误;
②开始pH相同,则氢离子浓度相同,所以开始时反应速率A=B,故②错误;
③由于生成的氢气体积相同,所以参加反应的锌粉物质的量A=B,故③正确;
④醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故④正确;
故选③④;

 智慧小复习系列答案
智慧小复习系列答案



