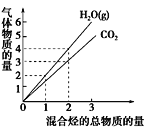
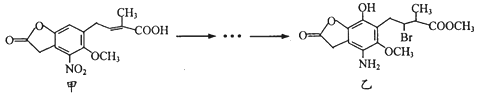
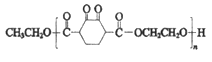
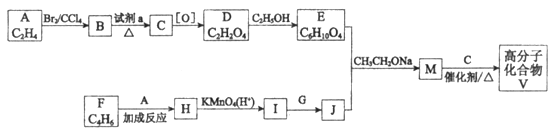
题目内容
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,其中离子交换膜I、II分别是氯离子交换膜和钠离子交换膜中的一种,图中有机废水中的有机物可用C6H10O5表示。下列有关说法正确的是

A. a电极为该电池的负极,离子交换膜I是钠离子交换膜
B. a电极附近溶液的氯离子浓度增大,b电极附近溶液的pH减小
C. a电极的电极反应式为C6H10O5-24e-+7H2O=6CO2↑+24H+
D. 中间室中Na+移向左室,Cl—移向右室
【答案】C
【解析】
该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+。
A项、a电极为该电池的负极,负极反应生成氢离子,为维持溶液呈电中性,咸水中阴离子Cl-移向负极室左室,则离子交换膜I是氯离子交换膜,故A错误;
B项、电解质溶液中阴离子Cl-移向负极室左室,a电极附近溶液的氯离子浓度增大,b电极消耗氢离子,溶液的pH增大,故B错误;
C项、a电极是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O═6CO2↑+24H+,故C正确;
D项、放电时,电解质溶液中阳离子Na+移向正极右室,阴离子Cl-移向负极室左室,故D错误。
故选C。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案【题目】某研究性学习小组在网上收集到信息:钠、镁等活泼金属都能在CO2气体中燃烧。
他们对钠在CO2气体中燃烧后得到的白色产物进行了如下探究:
[实验操作]将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底有黑色颗粒,瓶壁上附着白色物质。
[提出假设]假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计方案]该小组对燃烧后生成的白色物质进行如下探究:
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液。 ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀 ②无明显现象 | 白色物质为Na2CO3 |
请回答下列问题:
(1)写出金属镁与二氧化碳反应的化学方程式:________________________。
(2)甲同学认为方案1得到的结论不正确,其理由是____________________。
(3)钠在二氧化碳中燃烧的化学方程式为______________________________。
(4)乙同学认为白色物质有可能是氢氧化钠。你是否同意乙同学的观点,并简述理由:__________。
【题目】某实验小组收集“铜与浓硝酸反应”生成的气体进行探究。试回答下列问题
(1)下图是“铜与浓硝酸反应”的实验装置
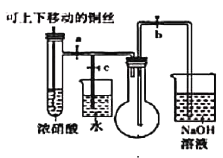
①指出装置中的错误_________________________。
②装置改进后,为了使生成的气体充满烧瓶,实验时先关闭弹簧夹_______,再打开弹簧夹________。
③当气体充满烧瓶后,___________________________,即可使反应停止。
(2)当烧瓶中充满红棕色的气体时停止实验,取下烧瓶,塞好橡皮塞。
①把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,烧瓶中水面上升,根据化学方程式3NO2+H2O=2HNO3+NO计算烧瓶中溶液的浓度是______mol/L(假设溶质未扩散到水槽,且当时条件下气体的摩尔体积为25L/mol)
②把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,实验时发现烧瓶中液面上升几乎充满了整个烧瓶,产生这种现象的原因可能是收集的NO2中含有__________。
A.NO B.N2O4 C.O2 D.空气
③小组同学查阅资料发现,NO2溶于水时能生成硝酸和亚硝酸:2NO2+H2O=HNO3+HNO2,为了证明这是造成剩余气体少的主要原因,小组同学把烧瓶中的溶液滴加高锰酸钾溶液,发现高锰酸钾溶液褪色,写出高锰酸钾溶液褪色的离子方程式____________________________。
(3)HNO2是一种不稳定易分解的弱酸:Ⅰ.2HNO2=NO↑+NO2↑+H2O,Ⅱ.3HNO2=HNO3+2NO↑+H2O。为了探究不同温度、浓度下亚硝酸的分解产物,小组同学进行如下实验:
第一步:配制1mol/LNaNO2溶液100mL(标为溶液A)。
第二步:取溶液A分别加水稀释为0.5mol/L、0.2mol/L、0.1mol/L的溶液,依次标为溶液B、C、D。
第三步:分别取两滴管溶液A~D溶液于试管中,塞上橡皮塞后置于不同温度的水中加热5min,再加入一滴管10mol/LH2SO4溶液并立即塞紧橡皮塞,观察生成气体的颜色
水浴温度/℃ | A | B | C | D |
沸水浴 | 红棕色 | 红棕色 | 红棕色 | 红棕色 |
80-70 | 红棕色 | 红棕色 | 红棕色 | 无色 |
50-40 | 红棕色 | 仅液面上红棕色 | 无色 | 无色 |
20-10 | 仅液面上红棕色 | 无色 | 无色 | td style="width:88.95pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.03pt; vertical-align:middle">
①第一步实验要用到玻璃仪器有:烧杯、100mL容量瓶、玻璃棒和___________。
②用NaNO2溶液加硫酸而不直接用HNO2溶液的原因是______________。
③通过实验现象得出结论:____________条件下,亚硝酸按反应Ⅰ发生分解。