题目内容
【题目】迄今为止我国相关部门已经发布了113号Nh、115号Mc、116号Lv、117号Ts、118号Og等元素的中文名称分别是:![]() ,下列有关推断正确的是
,下列有关推断正确的是
A. 这五种元素均为主族元素
B. 根据该名称,周期表118种元素中非金属元素共有24种
C. Nh的最高价氧化物是一种典型的两性氧化物
D. Ts的简单阴离子比该族上一周期简单阴离子的还原性弱
【答案】B
【解析】
A.113号Nh、115号Mc、116号Lv、117号Ts,分别为第ⅢA、ⅤA、VIA、ⅤⅡA,118号元素为稀有气体元素,为0族元素,故A错误;
B.根据该名称,周期表118种元素中非金属元素有:氢、氦、硼、碳、氮、氧、氟、氖、硅、磷、硫、氯、氩、砷、硒、溴、氪、碲、碘、氙、砹、氡、![]() 和
和![]() 共有24种,故B正确;
共有24种,故B正确;
C.113号Nh元素有7个电子层,最外层有3个电子,位于第七周期,第ⅢA族,根据同一主族元素性质递变规律,可推知Nh的最高价氧化物显强碱性,故C错误;
D.卤族元素从上到下,元素的非金属性逐渐减弱,简单阴离子的还原性逐渐增强,所以Ts的简单阴离子比该族上一周期简单阴离子的还原性强,故D错误。
故选B。

【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)常温下0.1 mol·L-1的CH3COOH溶液,若升髙温度,上述4种表达式的数据增大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C. c(H+)·c(OH-) D.c(CH3COO-)·c(H+)/c(CH3COOH)
(3)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
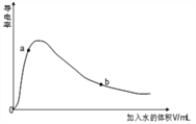
n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(4)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题:
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,写出相应的化学方程式____________________________________________。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ 1/2O2(g)的ΔH=_______ kJ·mol1。
②t=62 min时,测得体系中pO2=2.9 kPa,则此时的pN2O5=________kPa。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)__________63.1 kPa(填“大于”“等于”或“小于”),原因是______________________________________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=____________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=____________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_____________(填标号)。 A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物只有NO3 C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高