题目内容
14.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+,Zn在这些化合物中的化合价均为+2.回答下列问题:(1)写出锌和氢氧化钠溶液反应的化学方程式Zn+2NaOH+2H2O=Na2[Zn(0H)4]+H2↑.
(2)写出氯化铝溶液与氨水反应的离子方程式Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(3)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因可溶性锌盐与氨水反应产生的氢氧化锌可溶于过量的氨水中,生成Zn(NH3)42+,氨水的量不易控制.
分析 (1)锌和氢氧化钠的反应与金属铝和氢氧化钠的反应相似;
(2)可溶性铝盐与氨水反应可以获得氢氧化铝沉淀;
(3)可溶性锌盐与氨水反应获得氢氧化锌沉淀可以溶于过量的氨水中.
解答 解:(1)根据题干信息得锌和氢氧化钠溶液反应的化学方程式为:Zn+2NaOH+2H2O=Na2[Zn(0H)4]+H2↑,
故答案为:Zn+2NaOH+2H2O=Na2[Zn(0H)4]+H2↑;
(2)可溶性铝盐与氨水反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌,因为可溶性锌盐与氨水反应产生的氢氧化锌可溶于过量的氨水中,生成Zn(NH3)42+,氨水的量不易控制,
故答案为:可溶性锌盐与氨水反应产生的氢氧化锌可溶于过量的氨水中,生成Zn(NH3)42+,氨水的量不易控制.
点评 本题是一道信息给定题,主要是锌及其化合物性质类比铝及其化合物的性质,考查学生分析和解决问题的能力,难度中等.

练习册系列答案
相关题目
4.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标况下,11.2L SO3所含的分子数目为0.5 NA | |
| B. | 1L0.1 mol•L-1的碳酸氢钠溶液中含碳酸氢根离子数为0.1NA | |
| C. | 常温常压下,1.7gH2O2中含有的电子数为0.9nA | |
| D. | 8 Al+3 NH4ClO4═4 Al2O3+3NH3+3HCl 反应中,消耗27gAl粉时,转移的电子数目为2.75NA |
5.下列有关化学用语正确的是( )
| A. | Na+的基态电子排布图是: | |
| B. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1NA | |
| C. | Na2S的电子式: | |
| D. | 氯离子结构示意图为: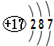 |
9.NA代表阿伏加德罗常数,下列有关叙述错误的是( )
| A. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| B. | 标准状况下22.4升CH4和C2H4的混合气体所含氢原子数为4NA28bNA | |
| C. | 常温常压下,3.4gNH3中含N-H键数目为0.6NA | |
| D. | CO2通过足量Na2O2使固体增重bg时,反应中转移的电子数为$\frac{b{N}_{A}}{2}$ |
19.下列叙述中不正确的是( )
| A. | 电解池的阳极上发生氧化反应,阴极上发生还原反应 | |
| B. | 原电池跟电解池连接后,电子从原电池负极流向电解池阴极 | |
| C. | 电镀时,电镀池里的阳极材料发生氧化反应 | |
| D. | 电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气 |
6.下列物质属于等电子体一组的是( )
| A. | CH3Cl和NH4+ | B. | B3H6N3和C6H6 | C. | CO2、NO2 | D. | H2O和CH4 |
3.将8g Al和Mg合金投入足量的盐酸中,经充分反应收集到标准状况下H2的体积4.48L,向反应后的溶液中加入足量的氨水溶液,经过滤干燥得到沉淀mg,m的值是( )
| A. | 10.4 | B. | 14.8 | C. | 13.6 | D. | 15.8 |
4.近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品.苹果酸(α羟基丁二酸)是这种饮料的主要酸性物质,其结构如图所示: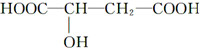
下列相关说法正确的是( )
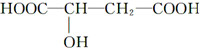
下列相关说法正确的是( )
| A. | 1mol苹果酸在一定条件下能与足量钠反应生成3mol氢气 | |
| B. | 苹果酸在一定条件下能催化氧化生成醛 | |
| C. | 苹果酸在一定条件下能发生加聚反应生成高分子化合物 | |
| D. | 1 mol苹果酸与NaHCO3溶液反应最多消耗2 mol NaHCO3 |