题目内容
3.目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点.(1)将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,配平下列离子方程式:
2Fe(OH)3+3ClO-+OH-═2FeO42-+3Cl-+5H2O
(2)用Fe做阳极,Cu做阴极,NaOH溶液做电解液,用电解的方法也可制得Na2FeO4,则电解过程中阳极的反应式为Fe+8OH--6e-=FeO42-+4H2O.
(3)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
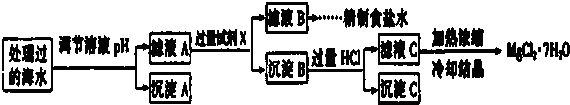
注:离子浓度小于10-5mol/L 可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=1.0×10-12;操作过程中溶液体积的变化忽略不计.
①表格中的a>0.16 (填“<”或“=”或“>”).
②沉淀A的组成为Fe(OH)3(填化学式);在调节溶液pH时,理论上应调节的pH的范围是3≤pH<9.
③加入的过量试剂X为Ba(OH)2 (填化学式).
④加入过量HCl的作用为使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解.
分析 (1)反应中Fe(OH)3→FeO42-,Fe元素化合价由+3升高为+6价,总共升高3价,ClO-→Cl-,Cl元素化合价由+1价降低为-1价,总共降低2价,化合价升降最小公倍数为6,故Fe(OH)3系数为2,故ClO-系数为3,由元素守恒可知,FeO42-系数为2,Cl-系数为3,根据电荷守恒可知,反应物OH-系数为4,根据H元素、O元素守恒可知,H2O其系数为5;
(2)用电解法制备铁酸钠,电解时铁失去电子发生氧化反应结合氢氧根离子生成铁酸跟离子和水;
(3)①由表中Mg2+、Fe3+的浓度及Ksp[Fe(OH)3、Ksp[Mg(OH)2]可知,该溶液呈酸性,再利用电荷守恒可知,2c(SO42-)+c(Cl-)+c(OH-)=2c(Mg2+)+3c(Fe3+)+c(Na+)+c(H+),据此判断;
②由工艺流程图可知,处理的海水调节PH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+;Mg2+完全沉淀时c(OH-)=10-5mol/L,PH值为9,Fe3+完全沉淀时c(OH-)=10-11mol/L,pH值为3;
③由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,据此判断X;
④由工艺流程图可知,盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,抑制Mg2+水解.
解答 解:(1)反应中Fe(OH)3→FeO42-,Fe元素化合价由+3升高为+6价,总共升高3价,ClO-→Cl-,Cl元素化合价由+1价降低为-1价,总共降低2价,化合价升降最小公倍数为6,故Fe(OH)3系数为2,故ClO-系数为3,由元素守恒可知,FeO42-系数为2,Cl-系数为3,根据电荷守恒可知,反应物OH-系数为4,根据H元素、O元素守恒可知,生成物H2O系数为5,配平后的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2、3、4,2、3、5;
(2)用铁做阳极电解氢氧化钠制备铁酸钠,电解时铁失去电子发生氧化反应结合氢氧根离子生成铁酸跟离子和水,电极反应式为:Fe+8OH--6e-=FeO42-+4H2O;
故答案为:Fe+8OH--6e-=FeO42-+4H2O;
(3)①由Ksp[Fe(OH)3、Ksp[Mg(OH)2]可知,Mg2+完全沉淀时c(OH-)=10-7mol/L,Fe3+完全沉淀时c(OH-)=10-11mol/L,由表中Mg2+、Fe3+的浓度可知,该溶液呈酸性,c(H+)>c(OH-),利用电荷守恒可知,2c(SO42-)+c(Cl-)+c(OH-)=2c(Mg2+)+3c(Fe3+)+c(Na+)+c(H+),即2a+0.58+c(OH-)=2×0.05+3×0.1+0.5+c(H+),整理2a=0.32+c(H+)-c(OH-),由于c(H+)>c(OH-),所以a>0.16,
故答案为:>;
②由工艺流程图可知,处理的海水调节PH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+,故沉淀A的组成为Fe(OH)3,Mg2+完全沉淀时c(OH-)=10-5mol/L,PH值为9,Fe3+完全沉淀时c(OH-)=10-11mol/L,pH值为3,在调节溶液pH时,应当使3≤pH<9,
故答案为:Fe(OH)3;3≤pH<9;
③由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,故试剂X为Ba(OH)2.
故答案为:Ba(OH)2;
④由工艺流程图可知,盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,可以抑制Mg2+水解,
故答案为:使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解.
点评 本题综合考查氧化还原反应、溶度积计算、沉淀转化、溶液的有关计算、对化学工艺流程的理解、物质的分离提纯等,(3)①为易错点、难点,根据电荷守恒判断原理、判断溶液的酸碱性是关键,题目难度中等.

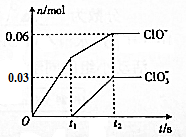 将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )| A. | 3:7 | B. | 7:3 | C. | 3:2 | D. | 2:3 |
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 将②、③混合,若pH=7,则消耗溶液的体积②=③ | |
| C. | 将四份溶液稀释相同的倍数后,溶液的pH:③>④>②>① | |
| D. | 将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液一定呈碱性 |
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式
 ,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯
,要想提高苯甲酸的转化率,可以采取的措施是加入过量的甲醇、移去苯甲酸甲酯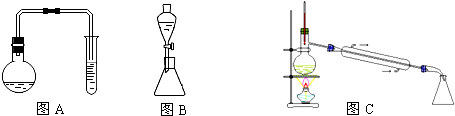
实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置后,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6 0C 时,可用锥形瓶收集苯甲酸甲酯.
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(4)为确定浓硫酸对此反应存在催化作用,可另取等量反应物在不加浓硫酸情况下进行相同程度的加热,然后测量两个实验中的某种数据,该数据是相同时间内两个试管里生成有机层的厚度或两个试管中生成相同厚度的有机层所需的时间.
| A. | 0.3mol O2和 0.3mol H2O | |
| B. | 0.1mol H2SO4和3.6g H2O | |
| C. | 0.1mol MgSO4•7H2O和0.1mol C12H22O11(蔗糖) | |
| D. | 6.02×1023个CO2与0.1mol KMnO4 |
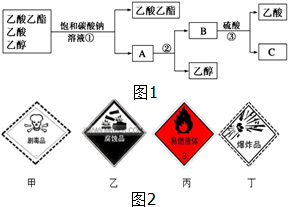 (1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.
(1)如图1是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图,在上述实验过程中,所涉及的三次分离操作的名称分别是①分液②蒸馏③蒸馏.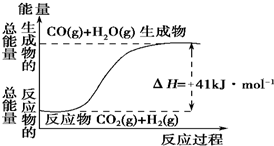 (1)根据如图所示情况,判断下列说法中正确的是B.
(1)根据如图所示情况,判断下列说法中正确的是B.