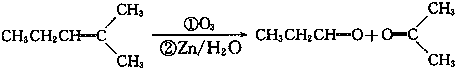题目内容
14.(1)设计一个简单的一次性完成实验的装置,验证醋酸、二氧化碳水溶液(碳酸)和苯酚的酸性,其强弱的顺序是:CH3COOH>H2CO3>C6H5OH①利用如图仪器可以组装实验装置,则仪器的连接顺序是:ADEBCF.
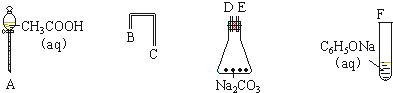
②写出实验过程中发生反应的实验现象锥形瓶中有大量气泡产生、F试管里变浑浊.
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为5.6×10-5mo1/L.
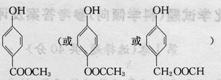
分析 (1)将A中的CH3COOH与Na2CO3发生反应:Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑,说明酸性CH3COOH>H2CO3;产生的CO2气体通入苯酚钠溶液发生反应: 说明酸性H2CO3>
说明酸性H2CO3>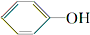 ;
;
(2)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答 解:(1)①醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH,根据强酸制取弱酸知,醋酸和碳酸钠反应制取二氧化碳,二氧化碳和苯酚钠溶液反应制取苯酚,所以仪器的连接顺序是:A→D→E→B→C→F,故答案为:ADEBCF;
②碳酸钠和醋酸反应方程式为:Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑,所以锥形瓶中有大量气泡产生,二氧化碳和苯酚钠溶液反应方程式为 ,所以F试管里变浑浊,
,所以F试管里变浑浊,
故答案为:锥形瓶中有大量气泡产生;F试管里变浑浊;
(2)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{1×1{0}^{-4}}$mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
故答案为:5.6×10-5mo1/L.
点评 本题考查了探究顺序强弱实验、溶度积的有关计算,明确物质的性质是解本题关键,结合强酸制取弱酸实验原理来分析解答,题目难度不大.


| A. | NaCl溶液的密度 | B. | NaCl溶液的浓度 | ||
| C. | NaCl溶液的酸碱性 | D. | NaCl溶液的导电性 |
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 | |
| D. | 打开啤酒瓶盖后产生大量的气泡 |
(1)常温下,浓度均为 0.l mol•L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②浓度均为0.0l mol•L-1的下列五种物质的溶液中,酸性最强的是D(填编号);将各溶液分别稀释100倍,pH变化最小的是C(填编号)
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是D(填编号)
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+NaClO═NaHCO3+HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-+H2O=CO2↑+Cl-+HClO.
(2)已知常温下Cu(OH)2的Ksp=2×10-20.又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol•L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于5.
| A. | 充放电时,溶液中Pb2+浓度保持不变 | |
| B. | 放电时转移2mol电子,消耗2molPb | |
| C. | 放电时的负极反应式为:Pb-2e-═Pb2+ | |
| D. | 充电时的阳极反应式为:Pb2++4OH+2e-═PbO2+2HO |
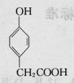
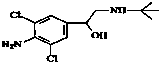 今年央视“315特别行动”又曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某“瘦肉精”中含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,不正确的是( )
今年央视“315特别行动”又曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某“瘦肉精”中含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,不正确的是( )| A. | 该物质的分子式为C12H18ON2Cl2 | |
| B. | 该物质可与盐酸反应 | |
| C. | 该物质的核磁共振氢谱图中有8个吸收峰 | |
| D. | 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等 |
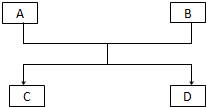 已知A、B、C、D的组成元素都属于短周期元素,其中A、D为单质,B、C为化合物,它们之间的关系转化如图所示,请按要求写出有关反应式,是离子反应的只写离子方程式.
已知A、B、C、D的组成元素都属于短周期元素,其中A、D为单质,B、C为化合物,它们之间的关系转化如图所示,请按要求写出有关反应式,是离子反应的只写离子方程式.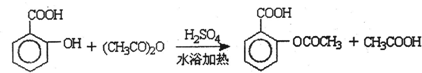
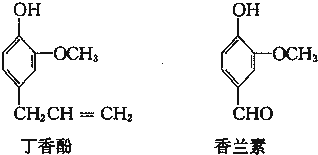
 、
、 .
.