题目内容
10.A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期,A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;若B的阳离子比C的阴离子少一个电子层,下列叙述正确的是( )| A. | 原子序数:A>B>D>C | B. | 非金属性:C>A | ||
| C. | 金属性:D>B | D. | 原子半径:B>D>C>A |
分析 A、B、C、D为四种短周期元素,A、C同主族,A的气态氢化物比C的气态氢化物稳定,故A、C为非金属,原子序数C>A,A处于第二周期,C处于第三周期;
B的阳离子比C的阴离子少一个电子层,则B处于第三周期,且为金属元素,B、D同周期,B的阳离子比D的阳离子氧化性强,则金属性B<D,故原子序数B>D,据此进行解答.
解答 解:A、B、C、D为四种短周期元素,A、C同主族,A的气态氢化物比C的气态氢化物稳定,故A、C为非金属,原子序数C>A,A处于第二周期,C处于第三周期;B的阳离子比C的阴离子少一个电子层,则B处于第三周期,且为金属元素,B、D同周期,B的阳离子比D的阳离子氧化性强,则金属性B<D,
A.A处于第二周期,B、C、D处于第三周期,A的原子序数最小,B、D为金属、C为非金属,金属性B<D,同周期自左而右金属性减弱、非金属性增强,故原子序数C>D>B,所以原子序数:C>B>D>A,故A错误;
B.A、C同主族,A的气态氢化物比C的气态氢化物稳定,非金属性:A>C,故B错误;
C.B的阳离子比D的阳离子氧化性强,则金属性:D>B,故C正确;
D.同周期从左到右元素原子半径逐渐减小,所以原子半径:D>B>C,同主族从上到下原子半径逐渐增大,所以C>A,则原子半径大小为:D>B>C>A,故D错误;
故选C.
点评 本题考查元素周期表的结构、元素周期律等知识,题目难度中等,确定元素的相对位置关系,注意对元素周期律理解掌握,明确原子半径大小比较的方法.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
20.下列实验操作中正确的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏时,温度计水银球靠近蒸馏烧瓶的支管口处,且冷却水从冷凝管的上口通入下口流出 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 向1 mol•L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 |
1.保证食品安全,保持营养均衡,是人体健康的基础.下列说法正确的是( )
| A. | 缺乏维生素C易发夜盲症 | |
| B. | 糖尿病患者吃糖量必须限制,但淀粉类事物不必进行限制 | |
| C. | 亚硝酸钠是一种常用的发色剂,但在食品加工或餐饮业中一定要严加控制使用量 | |
| D. | 餐饮业产生的“地沟油”的主要成分是油脂,一定条件下,油脂水解可以生成高级脂肪酸和甘油 |
18.湖南省常德市石门县鹤山村用土法炼砒霜导致地下水砷污染严重,157人中毒死亡.关于砷(33As)的说法不正确的是( )
| A. | 砷的氢化物和磷的氢化物的稳定性为PH3<AsH3 | |
| B. | 砷原子核内有33个质子 | |
| C. | 砷是第四周期第VA族 | |
| D. | 砷的最高价氧化物对应的水化物的化学式是H3AsO4 |
5.下列离子方程式中,正确的是( )
| A. | 一小块钾投入冷水中:K+2H2O═K++2OH-+H2↑ | |
| B. | 氯气通入碘化钠溶液中:2I-+Cl2═I2+2Cl- | |
| C. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
15.0.1mol某有机物的蒸气跟足量的O2混合后点燃,反应后生成13.2g CO2和5.4g H2O,该有机物能跟Na反应放出H2,又能跟新制Cu(OH)2反应生成红色沉淀,此有机物还可与乙酸反应生成酯类化合物,该酯类化合物的结构简式可能是( )
| A. | OHC-CH2-CH2COOCH3 | |
| B. |  | |
| C. | 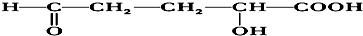 | |
| D. |  |
19.下列有关主族元素M、N非金属性强弱比较的说明中,正确的是( )
| 事实 | 非金属 | |
| A | 第I电离能 M<N | M>N |
| B | 电负性M=N | M=N |
| C | 基态原子价层电子排布 M:nsnnpn+3,N:nsnnpn+4 | M>n |
| D | 原子半径 M>N | M<N |
| A. | A | B. | B | C. | C | D. | D |
 .
.