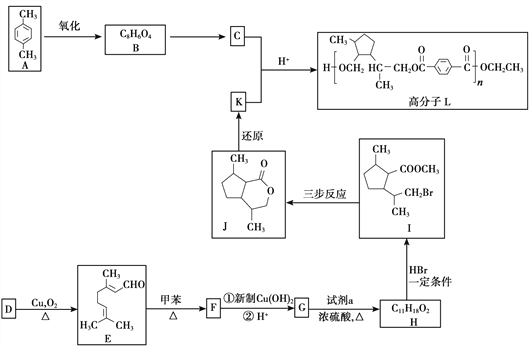
题目内容
【题目】Ⅰ.下面列出了几组物质,请将物质的合适序号填写在空格上。
①金刚石和石墨 ②D和T ③12C和13C ④O2和O3
⑤CH4和CH3CH2CH3 ⑥CH2=CHCH3和CH2=CH2
⑦CH3CH(CH3)CH2CH3和CH3(CH2)3CH3 ⑧ 和
和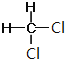
同系物____________;同分异构体____________。
Ⅱ.篮烷分子的键线式如图所示,试回答:
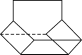
篮烷的一氯代物的种数为________种(不考虑立体异构)。
Ⅲ.在一定温度下,体积为2 L的恒容密闭容器中,NO2和N2O4之间发生反应2NO2(g) ![]() N2O4(g),如图所示。
N2O4(g),如图所示。
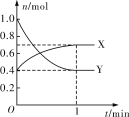
(1)曲线____________ (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)该反应达到限度时,Y的转化率是__________,反应开始时与反应达到平衡状态时的压强之比为__________。
【答案】 ⑤⑥ ⑦ 4 Y 60% 14∶11
【解析】Ⅰ.根据同系物和同分异构体的概念分析判断;
Ⅱ.根据等效氢判断一氯代物数目;
Ⅲ.(1)根据物质的量的变化量之比等于计量数之比分析;(2)根据v=![]() 计算反应速率;根据在相同条件下,气体的压强之比等于物质的量之比计算。
计算反应速率;根据在相同条件下,气体的压强之比等于物质的量之比计算。
Ⅰ. ①金刚石和石墨是同素异形体;②D和T属于同位素;③12C和13C属于同位素;④O2和O3是同素异形体;⑤CH4和CH3CH2CH3的结构相似,组成上相差2个CH2,是同系物;⑥CH2=CHCH3和CH2=CH2的结构相似,组成上相差1个CH2,是同系物;⑦CH3CH(CH3)CH2CH3和CH3(CH2)3CH3的分子式相同,结构不同,是同分异构体;⑧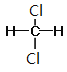 和
和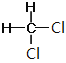 的结构相同,是同一种物质,因此属于同系物的有⑤⑥;属于同分异构体的有⑦,故答案为:⑤⑥;⑦;
的结构相同,是同一种物质,因此属于同系物的有⑤⑥;属于同分异构体的有⑦,故答案为:⑤⑥;⑦;
Ⅱ.该有机物分子属于高度对称结构,有如图所示: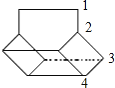 的4种H原子,则其一氯代物有4种,故答案为:4;
的4种H原子,则其一氯代物有4种,故答案为:4;
Ⅲ.(1)由方程式2NO2(g) ![]() N2O4(g) 可知,反应中NO2的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
N2O4(g) 可知,反应中NO2的物质的量变化较大,则Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
(2)该反应达最大限度时,Y的转化率为![]() ×100%=60%,开始时:n(X)+n(Y)=0.4mol+1mol=1.4mol,平衡时:n(X)+n(Y)=0.7mol+0.4mol=1.1mol,在相同条件下,气体的压强之比等于物质的量之比,则反应开始时与反应达平衡状态时的压强之比为1.4mol:1.1mol=14:11,故答案为: 60%;14:11。
×100%=60%,开始时:n(X)+n(Y)=0.4mol+1mol=1.4mol,平衡时:n(X)+n(Y)=0.7mol+0.4mol=1.1mol,在相同条件下,气体的压强之比等于物质的量之比,则反应开始时与反应达平衡状态时的压强之比为1.4mol:1.1mol=14:11,故答案为: 60%;14:11。

【题目】实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如图: 
(1)①写出铜帽溶解过程中铜发生反应的化学方程式 . ②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是 .
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH至3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下: 2Cu2++4I﹣=2CuI(白色)↓+I2 I2+2S2O32﹣=2I﹣+S4O62﹣
①滴定选用的指示剂为 , 滴定终点观察到的现象为 .
②若滴定前溶液中H2O2没有除尽,所测得的Cu2+的含量将会(填“偏高”、“偏低”、“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣ . 下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算)
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
完全沉淀的pH | 3.2 | 8.8 | 8.9 |
实验中可选用的试剂:30% H2O2、1.0molL﹣1HNO3、1.0molL﹣1 NaOH.
由回收铜后的滤液制备ZnO的实验步骤依次为:
①向滤液中加入略过量 , 使其充分反应
②向反应后的溶液中滴加1.0moLL﹣1的NaOH溶液,调节溶液的pH范围为;
③过滤;
④向滤液中滴加1.0moLL﹣1的氢氧化钠,调节pH范围为;
⑤过滤、洗涤、干燥
⑥900℃煅烧.