��Ŀ����
����Ŀ������������գ�
��1��2SO2��g��+O2��g��2SO3��g����Ӧ���̵�����仯��ͼ��ʾ����֪1mol SO2��g������Ϊ1mol SO3��g���ġ�H=��99kJ/mol�� 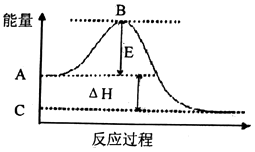
��ش��������⣺
��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ������С����ޡ���Ӱ����
��ͼ�С�H=kJ/mol��
��2����������������Ӧ����1molˮ�������ų�241.8kJ������25�桢101kPa�²�ã� ��д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
����lmolˮ����ת��ΪҺ̬ˮ����45kJ����ӦH2��g��+ ![]() O2��g��=H2O��l���ġ�H=kJ/mol��
O2��g��=H2O��l���ġ�H=kJ/mol��
���𰸡�
��1���ޣ���198
��2��H2��g��+ ![]() O2��g���TH2O��g����H=��241.8kJ/mol����286.8
O2��g���TH2O��g����H=��241.8kJ/mol����286.8
���������⣺��1����EΪ��ܣ���Ӧ�ȿɱ�ʾΪA��C��ܵĴ�С֮���ܵĴ�С�뷴Ӧ���أ����Դ��ǣ��ޣ�
����1mol SO2��g������Ϊ1mol SO3�ġ�H=��99kJmol��1������2molSO2��g������Ϊ2molSO3�ġ�H=��198kJmol��1����2SO2��g��+O2��g��=2SO3��g����H=��198KJmol��1�����Դ��ǣ���198����2�����٣�������������Ӧ����1molˮ��������241.8kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��H2��g��+ ![]() O2��g���TH2O��g����H=��241.8kJ/mol��
O2��g���TH2O��g����H=��241.8kJ/mol��
���Դ��ǣ�H2��g��+ ![]() O2��g���TH2O��g����H=��241.8kJ/mol��
O2��g���TH2O��g����H=��241.8kJ/mol��
����1molˮ����ת��ΪҺ̬ˮ����45kJ����H2O��g��=H2O��l����H=��45kJ/mol��
i��H2��g��+ ![]() O2��g���TH2O��g����H=��241.8kJ/mol
O2��g���TH2O��g����H=��241.8kJ/mol
ii��H2O��g��=H2O��l����H=��45kJ/mol
i+ii��H2��g��+ ![]() O2��g���TH2O��l����H=��286.8kJ/mol
O2��g���TH2O��l����H=��286.8kJ/mol
���Դ��ǣ���286.8��
�����㾫�������ڱ��⿼��ķ�Ӧ�Ⱥ��ʱ䣬��Ҫ�˽��ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�Ȳ��ܵó���ȷ�𰸣�

 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д�����Ŀ���������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ����������Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��գ� 
��1������ͼװ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2 �� д����������ClO2�ĵ缫��Ӧʽ�� �� �ڵ��һ��ʱ�䣬�������������������Ϊ112mL����״����ʱ��ֹͣ��⣮ͨ�������ӽ���Ĥ�������ӵ����ʵ���Ϊmol��
��2��Ϊ��״�ȼ�ϵ������ʣ���ѧ�ҷ�����һ��ȼ�ϵ�أ���ص�һ���缫ͨ���������һ���缫ͨ��״����壬������Dz�����Y2O3��ZrO2���壬�ڸ��������ܴ���O2�����ӣ���ع���ʱ������ӦΪ ��
��3�����Ըõ��Ϊ��Դ����ʯī���缫���100mL�����������ӵ���Һ��
���� | Cu2+ | H+ | Cl�� | SO42�� |
c/molL��1 | 1 | 4 | 4 | 1 |
���һ��ʱ��������ռ�����ͬ�������ͬ������������ʱ��������Һ����ı仯���缫������ܴ��ڵ��ܽ������������ռ������������ʵ���Ϊmol��