题目内容
【题目】SiCl4在室温下为无色液体,易挥发,有强烈的刺激性。把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅。一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3的反应:3SiCl4(g)+2H2(g)+Si(s)SiHCl3(g),△H=QkJmol-1,2min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1mol/L和0.2mol/L。
(1)从反应开始到平衡,v(SiCl4)=_______
(2)该反应的平衡常数表达式为K=_______,温度升高,K值增大,则Q__0(填“>”、“<”或“=”)。
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将____(填“增大”、“减小”或“不变”)。
(4)原容器中,通入H2的体积(标准状况下)为_________
(5)平衡后,将容器的体积缩为10L,再次达到平衡时,H2的物质的量浓度范围为__________
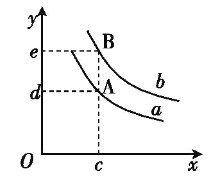
(6)图中x轴表示温度,y轴表示平衡混合气中H2的体积分数,a、b表示不同的压强,则压强a____b(填“>”、“<”或“=”)。
【答案】0.075mol/(L·min) ![]() > 减小 89.6L 0.1mol/L<c(H2)<0.2mol/L >
> 减小 89.6L 0.1mol/L<c(H2)<0.2mol/L >
【解析】
(1)利用三段分析法,根据平衡时H2与SiHCl3物质的量浓度,求出的起始H2物质的量以及2分钟时转化的物质的量,在根据v(H2)=![]() 计算出氢气的反应速率,最后根据反应速率之比等于系数之比求出v(SiCl4);
计算出氢气的反应速率,最后根据反应速率之比等于系数之比求出v(SiCl4);
(2)根据反应的平衡常数等于生成物各物质的浓度的幂次方之积比反应物各物质的浓度的幂次方之积,注意纯固体或者纯液体不列出;温度升高,K值增大,说明平衡向正反应方向移动,正反应方向即为吸热方向;
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),等效于先将容器扩大一倍,在压缩增大压强平衡向着体积减小的方向移动即正方向移动,故H2的体积分数将减小;
(4)根据(1)三段分析法进行计算;
(5)平衡后,将容器的体积缩为10L,相当于增大压强平衡要向正方向移动进行判断;
(6)由图象曲线的变化特点可知,采用“定一仪二”法讨论。
(1)由方程式可知
3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g)
4SiHCl3(g)
起始量(mol) n 0
变化量(mol) 2x 4x
平衡量(mol) n-2x 4x
4x=0.2mol/L×20L=4mol,x=1mol;n-2x=0.1mol/L×20L=2mol,n=4mol,则v(H2)=![]() =
=![]() =0.05molL-1min-1,根据反应速率之比等于系数之比可得v(SiCl4)=
=0.05molL-1min-1,根据反应速率之比等于系数之比可得v(SiCl4)=![]() v(H2)=0.075molL-1min-1;
v(H2)=0.075molL-1min-1;
(2)根据反应的平衡常数等于生成物各物质的浓度的幂次方之积比反应物各物质的浓度的幂次方之积,K=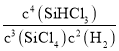 ;温度升高,K值增大,说明平衡向正反应方向移动,正反应方向即为吸热方向,所以Q>0;
;温度升高,K值增大,说明平衡向正反应方向移动,正反应方向即为吸热方向,所以Q>0;
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),等效于先将容器扩大一倍,在压缩相当于增大压强平衡向着体积减小的方向移动即正方向移动,故H2的体积分数将减小;故答案:减小;
(4)根据(1)三段分析法计算得,通入H2的体积(标准状况下)为4mol×22.4mol/L=89.6L;
(5)平衡后,将容器的体积缩为10L,如果平衡不移动H2的物质的量浓度变成原来的2倍即![]() ×2=0.2mol/L,但是体积压缩相当于增大压强平衡要向正方向移动进行,H2的物质的量浓度还要减小,但根据勒夏特列原理,再减小也会比原来的大;故答案为0.1molL-1<c(H2)<0.2molL-1;
×2=0.2mol/L,但是体积压缩相当于增大压强平衡要向正方向移动进行,H2的物质的量浓度还要减小,但根据勒夏特列原理,再减小也会比原来的大;故答案为0.1molL-1<c(H2)<0.2molL-1;
(6)由图象曲线的变化特点可知,采用“定一仪二”法讨论,定温度相同,增大压强,平衡向正反应的方向移动,H2的体积分数减小,则说明a>b。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案