题目内容
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:

试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学反应方程式:___________。
(2)B装置有三种功能;①控制气流速度;②混匀混合气体;③________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有___溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
A分液法 B蒸馏法 C结晶法
(5)将1molCH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为_____,生成HCl的物质的量共为________。
【答案】CH4 + Cl2![]() CH3Cl + HCl 干燥氯气 淀粉KI溶液 A 3mol 3mol
CH3Cl + HCl 干燥氯气 淀粉KI溶液 A 3mol 3mol
【解析】
紧扣主体反应:甲烷与氯气的光照取代反应,从原料的制备与混合、剩余反应物的检验、产物的分离入手,分析解答问题。主体反应是连续进行的四步取代反应,应用化学方程式计算参加反应的Cl2的物质的量和生成HCl的物质的量。
(1)装置C中,甲烷与氯气在光照条件下发生取代反应,其中生成CH3Cl的化学方程式为
CH4 + Cl2![]() CH3Cl + HCl。
CH3Cl + HCl。
(2)装置B中盛有浓硫酸,氯气、甲烷通过后进入装置C。可见装置B有三种功能:①控制气流速度;②混匀混合气体;③干燥氯气、甲烷。
(3)进入装置D的物质为甲烷的氯代物、氯化氢,以及未反应的甲烷、氯气,其中氯气能使湿润的淀粉碘化钾溶液变蓝。装置D中的棉花可能预先滴有淀粉碘化钾溶液。
(4)甲烷的氯代产物中,四种氯代物均不溶于水、只有氯化氢溶于水成盐酸。从装置E中分离出盐酸的最佳方法为分液法。
(5)设CH3Cl的物质的量为x,则CH2Cl2、CHCl3、CCl4的物质的量分别为x+0.1mol、x+0.2mol、x+0.3mol。则x+(x+0.1mol)+(x+0.2mol)+(x+0.3mol)=1 mol,解得x=0.1mol。
①CH4+Cl2![]() CH3Cl+HCl,生成0.1molCH3Cl,消耗0.1molCl2、生成0.1molHCl。
CH3Cl+HCl,生成0.1molCH3Cl,消耗0.1molCl2、生成0.1molHCl。
②CH4+2Cl2![]() CH2Cl2+2HCl,生成0.2molCH2Cl2,消耗0.4molCl2、生成0.4molHCl。
CH2Cl2+2HCl,生成0.2molCH2Cl2,消耗0.4molCl2、生成0.4molHCl。
③CH4+3Cl2![]() CHCl3+3HCl,生成0.3molCHCl3,消耗0.9molCl2、生成0.9molHCl。
CHCl3+3HCl,生成0.3molCHCl3,消耗0.9molCl2、生成0.9molHCl。
④CH4+4Cl2![]() CCl4+4HCl,生成0.4molCCl4,消耗1.6molCl2、生成1.6molHCl。
CCl4+4HCl,生成0.4molCCl4,消耗1.6molCl2、生成1.6molHCl。
共消耗3molCl2,生成3molHCl。

 中考解读考点精练系列答案
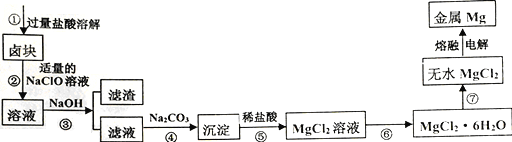
中考解读考点精练系列答案【题目】卤块的主要成分是MgCl2,还含有少量Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按如下流程进行生产,以制备金属镁。
本流程操作条件下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 10.0 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
*Fe2+氧氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+后生成Fe(OH)3沉淀除去。 请回答以下问题:
(1)步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施有 __________________________ (任写一条)。
(2)步骤②中NaClO的电子式为__________,加入NaClO溶液的目的是_________________________
(用离子方程式解释)。
(3)常温时,Mg(OH)2的Ksp=1.8×10-11。当溶液pH=10.0时,溶液中的c(Mg2+)=___________。
(4)若将步骤⑤中“稀盐酸”改为“加水、煮沸”的方式可以得到另一种沉淀物和一种无色无味的气体,请写出该反应的化学方程式__________________________________________。
(5)步骤⑥中涉及的操作是_____________________________,且⑥⑦操作均需在HCl气流中进行,其原因是_______________________________________。