题目内容
(14分)草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。

 请跟据以上信息回答下列问题:
请跟据以上信息回答下列问题:
(1)图示①②的氧化—水解过程是在上图1的装置中进行的,指出装置A的名称 。
(2)图示①②的氧化—水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸收率的影响,结果如上图2所示,请选择最佳的反应温度为 ,为了达到图2所示的温度,选择图1的水浴加热,其优点是 。
(3)在图示③④中的操作涉及到抽滤,洗涤、干燥,下列有关说法正确的是 。
A.在实验过程中,通过快速冷却草酸溶液,可以得到较大的晶体颗粒,便于抽滤
B.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
C.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验。
D.为了得到干燥的晶体,可以选择在坩埚中直接加热,并在干燥器中冷却。
(4)要测定草酸晶体(H2C2O4·2H2O)的纯度,称取7.200g制备的草酸晶体溶于适量水配成250mL溶液,取25.00mL草酸溶液于锥形瓶中,用0.1000mol/L酸性高锰酸钾溶液滴定
(5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O),
①取25.00mL草酸溶液的仪器是 ,
②在草酸纯度测定的实验过程中,下列说法正确的是: 。
A.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
B.移液管取草酸溶液时,需将尖嘴处的液体吹入锥形瓶,会使实验误差偏低
C.滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是: 。
④达到滴定终点时,消耗高锰酸钾溶液共20.00mL,则草酸晶体的纯度为 。

|
 请跟据以上信息回答下列问题:
请跟据以上信息回答下列问题:(1)图示①②的氧化—水解过程是在上图1的装置中进行的,指出装置A的名称 。
(2)图示①②的氧化—水解过程中,在硝酸用量、反应的时间等条件均相同的情况下,改变反应温度以考察反应温度对草酸收率的影响,结果如上图2所示,请选择最佳的反应温度为 ,为了达到图2所示的温度,选择图1的水浴加热,其优点是 。
(3)在图示③④中的操作涉及到抽滤,洗涤、干燥,下列有关说法正确的是 。
A.在实验过程中,通过快速冷却草酸溶液,可以得到较大的晶体颗粒,便于抽滤
B.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
C.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验。
D.为了得到干燥的晶体,可以选择在坩埚中直接加热,并在干燥器中冷却。
(4)要测定草酸晶体(H2C2O4·2H2O)的纯度,称取7.200g制备的草酸晶体溶于适量水配成250mL溶液,取25.00mL草酸溶液于锥形瓶中,用0.1000mol/L酸性高锰酸钾溶液滴定
(5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O),
①取25.00mL草酸溶液的仪器是 ,
②在草酸纯度测定的实验过程中,下列说法正确的是: 。
A.润洗滴定管时,应从滴定管上口加满所需的酸或碱液,使滴定管内壁充分润洗
B.移液管取草酸溶液时,需将尖嘴处的液体吹入锥形瓶,会使实验误差偏低
C.滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液
D.滴定终点读取滴定管刻度时,仰视标准液液面,会使实验误差偏高
③判断滴定已经达到终点的方法是: 。
④达到滴定终点时,消耗高锰酸钾溶液共20.00mL,则草酸晶体的纯度为 。
⑴三颈烧瓶(2分), ⑵70℃(1分), 便于控制温度,使装置受热均匀(2分)
⑶BC(2分) ⑷①酸式滴定管(1分) ②CD(2分)
③向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色。(2分)
④87.5%(2分)
⑶BC(2分) ⑷①酸式滴定管(1分) ②CD(2分)
③向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色。(2分)
④87.5%(2分)
试题分析:(1)根据装置的结构特点可知,A应该是三颈烧瓶。
(2)根据图2可知,在温度为70℃时,醋酸的收率最高,所以选择的最佳反应温度是70℃。由于温度不超过100℃,所以采用水浴加热,这是由于水浴加热时便于控制温度,且能使装置受热均匀。
(3)A、在实验过程中,通过快速冷却草酸溶液,得不到较大的晶体颗粒,应该是自然冷却,A不正确;B、在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物,防止沉淀溶解而造成损失,B正确;C、由于装置中存在压强差,所以为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量滤液于试管中进行相关实验,C正确;D、在坩埚中直接加热,容易使草酸晶体分解,D不正确,答案选BC。
(4)①草酸溶液显酸性,所以量取25.00mL草酸溶液的仪器是酸式滴定管。
②A、润洗滴定管时,应从滴定管上口加少量所需的酸或碱液,使滴定管内壁充分润洗,并不需要加满,A不正确;B、移液管取草酸溶液时,不能将尖嘴处的液体吹入锥形瓶,否则使实验误差偏高,B不正确;C、滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液,C正确;D、滴定终点读取滴定管刻度时,仰视标准液液面,由于读数自上而下逐渐增大,所以读数偏大,会使实验误差偏高,D正确,答案选CD。
③由于酸性高锰酸钾溶液显紫红色,所以滴定终点的判断依据是向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色。
④反应中消耗高锰酸钾的物质的量是0.02L×0.1000mol/L=0.002000mol,所以根据方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O可知,消耗草酸的物质的量是0.005000mol,因此原样品中草酸的物质的量是0.005000mol×
 =0.05000mol/L,则质量=0.05000mol/L×126g/mol=6.3g,所以草酸的纯度是
=0.05000mol/L,则质量=0.05000mol/L×126g/mol=6.3g,所以草酸的纯度是 ×100%=87.5%。
×100%=87.5%。
练习册系列答案
相关题目

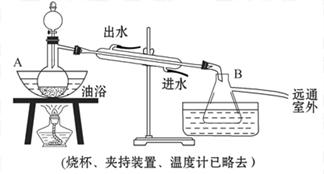

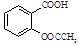 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的基本操作流程如下: