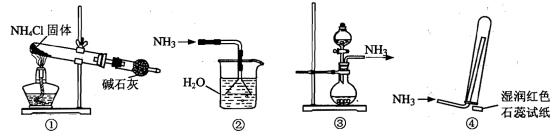
题目内容
(12分)SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:
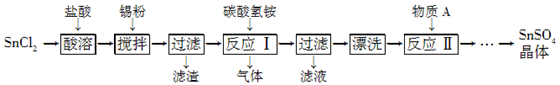
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl]。
(1) 写出物质A的名称:________。
(2) SnCl2用盐酸而不用水溶解的原因是____________________(用化学方程式表示)。
(3) 锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:______________________________。
(4) 反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:____。该反应的温度需要控制在75 ℃左右的原因是____。
(5) 实验室中“漂洗”沉淀的实验操作方法是____。

已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl]。
(1) 写出物质A的名称:________。
(2) SnCl2用盐酸而不用水溶解的原因是____________________(用化学方程式表示)。
(3) 锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:______________________________。
(4) 反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:____。该反应的温度需要控制在75 ℃左右的原因是____。
(5) 实验室中“漂洗”沉淀的实验操作方法是____。
(1) 硫酸(或硫酸溶液或稀硫酸)
(2) SnCl2+H2O
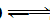 Sn(OH)Cl+HCl(不写可逆符号的也给分)
Sn(OH)Cl+HCl(不写可逆符号的也给分)(3) 2Sn2++O2+4H+===2Sn4++2H2O
(4) SnCl2+2NH4HCO3===SnO↓+2CO2↑+2NH4Cl+H2O
温度较低时反应速率小,温度较高时碳酸氢铵会分解(其他合理答案均可)
(5) (沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次
试题分析:(1)流程中前部分是溶解除杂过程,生成碳酸锡(反应1)再加硫酸溶解得到硫酸锡;(2)SnCl2能水解,用盐酸溶解为了抑制其水解;(3)信息中提出在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+;(4)要主要温度的控制不高于75 ℃和不低于75 ℃两个方面的原因,温度低反应速率低产量小,温度高反应物碳酸氢铵易分解;(5)“漂洗”沉淀就是洗涤沉淀,需要直接在过滤器中进行,(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
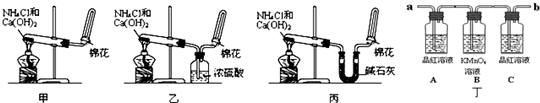
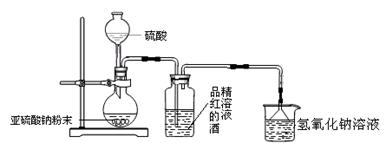

 Ca2++
Ca2++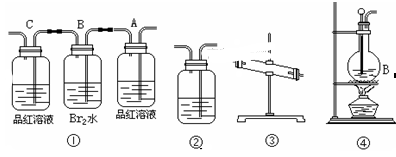
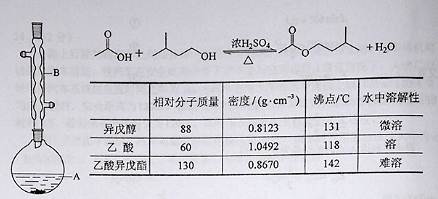

 请跟据以上信息回答下列问题:
请跟据以上信息回答下列问题: KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。
KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。