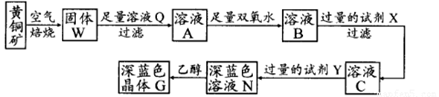
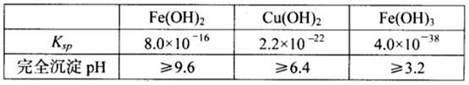
题目内容
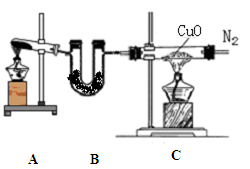
下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项中正确的是
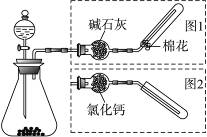
| 选项 | 发生装置中的药品 | 干燥和集气装置 |
| A | 电石和饱和食盐水 | 图2 |
| B | 大理石和稀盐酸 | 图1 |
| C | 铜和稀硝酸 | 图2 |
| D | 氧化钙和浓氨水 | 图1 |

D
试题分析:A、制备乙炔,密度比空气小,用图1收集,错误;B、产生二氧化碳,不能用碱石灰干燥,错误;C、产生一氧化氮与空气中氧气反应,不能用排空气法收集,错误;D、产生氨气,正确。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目


 请跟据以上信息回答下列问题:
请跟据以上信息回答下列问题:

 KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。
KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。