题目内容
14.发射航天器常以联氨(N2H4)为燃料,NO2为推进剂,燃烧生成氮气和水蒸气,火焰温度可达+22700°C,已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7KJ•mol-1①N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534KJ•mol-1②
H2O(g)═H2O(1)AH=-44kJ-mol-1 ③
2H2O2(1)═2H20(1)+O2(g)△H=-196.4KJ•mol-1④
$\frac{1}{2}$H2(g)+$\frac{1}{2}$F2(g)═HF(g)△H=-269KJ•mol-1⑤
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242KJ•mol-1⑥
请回答下列问题:
(1)对N2H4和NO2反应的说法不正确的是C
A.N2H4与NO2反应时NO2作氧化剂
B.氮气既是氧化产物,又是还原产物
C.生成lmolN2转移8mol电子
D.该反应的热化学方程式为2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7KJ•mol-1
(2)以往也曾用H2O2为助燃剂.试写出N2H4和H2O2反应生成气态水的热化学方程式:N2H4(g)+2H2O2(1)=N2(g)+4H2O(g)△H=-642.4KJ•mol-1.若生成1mol液态水放出热量204.6kJ
(3)有人认为若用氟气代替NO2作氧化剂,则反应释放的能量更大.试写出联氨与氟气反应的热化学方程式:2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1126kJ•mol-1.
分析 (1)将反应②×2-①可得2N2H4+2NO2=3N2+4H2O,反应中只有N元素化合价发生变化,为NO2氧化剂,N2H4为还原剂;
(2)将②+③×2+④可得N2H4和H2O2反应生成液态水的热化学方程式,并结合③得到生成气态水的热化学方程式;
(3)将②-⑤×3+⑥×4可得联氨与氟气反应的热化学方程式.
解答 解:(1)将反应②×2-①可得2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7KJ•mol-1,反应中只有N元素化合价发生变化,为NO2氧化剂,N2H4为还原剂,由方程式可知生成3molN2转移8mol电子,只有C错误,
故答案为:C;
(2)将②+③×2+④可得N2H4和H2O2反应生成液态水,反应的热化学方程式为N2H4(g)+2H2O2(1)=N2(g)+4H2O(l)△H=-818.4KJ•mol-1,
则生成气态水的热化学方程式为N2H4(g)+2H2O2(1)=N2(g)+4H2O(g)△H=-642.4KJ•mol-1,
生成1mol液态水放出热量为$\frac{818.4}{4}$kJ=204.6kJ,
故答案为:N2H4(g)+2H2O2(1)=N2(g)+4H2O(g)△H=-642.4KJ•mol-1;204.6;
(3)将②-⑤×3+⑥×4可得联氨与氟气反应的热化学方程式为2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1126kJ•mol-1,
故答案为:2N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1126kJ•mol-1.
点评 本题考查较为综合,涉及化学反应与能量以及氧化还原反应知识,题目难度中等,注意把握盖斯定律的应用以及热化学方程式的书写.

练习册系列答案
相关题目
4.物质的量浓度和体积均相同的下列溶液中,含阴离子种类最多的是( )
| A. | CaCl2 | B. | CH3COONa | C. | (NH4)2SO4 | D. | K2CO3 |
5.探究氯气是否具有漂白性实验如图:若关闭Ⅰ阀,打开Ⅱ阀,让一定量潮湿的氯气经过甲瓶后,进入乙瓶,乙瓶中布条不褪色.则甲瓶中所盛的试剂可能是:( )
①Na2SO3溶液 ②NaOH溶液 ③浓H2SO4 ④饱和NaCl溶液 ⑤KBr溶液.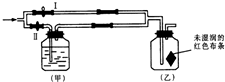
①Na2SO3溶液 ②NaOH溶液 ③浓H2SO4 ④饱和NaCl溶液 ⑤KBr溶液.

| A. | ②④ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②④ |
2.与纯水的电离相似,液氨中也存在着微弱的电离:2NH3?NH4++NH2-,据此判断以下叙述中不正确的是( )
| A. | 液氨中含有NH3、NH4+、NH2-微粒 | |
| B. | 其他条件不变,若增加液氨的量,电离平衡将正向移动 | |
| C. | 只要不加入其他物质,液氨中c(NH4+)=c(NH2-) | |
| D. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 |
19.如图为铁、铜水果电池装置示意图,下列说法正确的是( )
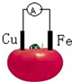

| A. | 铜片为负极 | B. | 铁片上发生还原反应 | ||
| C. | 电子由铁片沿导线流向铜极 | D. | 该装置将电能转变为化学能 |
3.下列有关反应的颜色变化不正确的是( )
| A. | 氯水久置后黄绿色消失 | |
| B. | 淀粉溶液遇碘单质变蓝 | |
| C. | SO2使品红溶液褪色 | |
| D. | 溴水中加入CCl4溶液,振荡静置后,上层呈橙红色 |
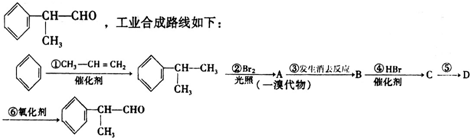
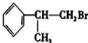 或
或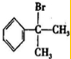 .
.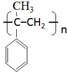 .
.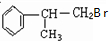 +NaOH$→_{△}^{H_{2}O}$NaBr+
+NaOH$→_{△}^{H_{2}O}$NaBr+ ,其反应类型为取代反应.
,其反应类型为取代反应. (或
(或 ).
).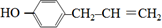 、
、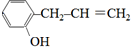 、
、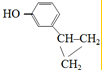 .
.