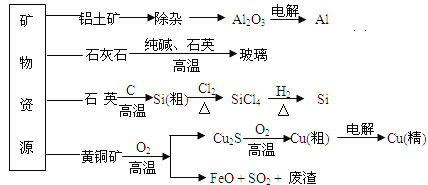
题目内容
【题目】氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)
4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是

A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
D. 氮气氧化为NO的热化学方程式为:N2(g)+O2(g)![]() 2NO(g)△H=-181.5kJ/mol
2NO(g)△H=-181.5kJ/mol
【答案】A
【解析】
A.图象分析判断,在780~840℃之间一氧化氮的产率接近100%,从转化率的大小与温度的关系选择反应的适宜温度;B.根据外界条件对氨催化氧化生成NO的化学平衡的影响分析C.反应是气体体积增大的反应,增大压强平衡向气体体积减小的方向进行;D.依据热化学方程式和 盖斯定律计算分析判断;
解析:
A.从图象可以看在,反应温度在780~840℃,NO的产率最大,故选择800℃左右,工业上进行氨催化氧化生成 NO时,温度应控制在780~840℃之间,故A正确;
B.4NH3(g)+5O2(g)4NO(g)+6H2O(g);△H=-905kJmol-1该反应是气体体积增大的、放热的反应,为了提高氨催化氧化生成NO的产率,需使化学平衡向正反应方向移动,可采取减小压强、降低温度、增大NH3的浓度,主要是提高一氧化氮的产率,故B错误;
C.反应是气体体积增大的反应,增大压强平衡向气体体积减小的方向进行,平衡逆向进行,反应物转化率减小,故C错误;
D.4NH3(g)+5O24NO(g)+6H2O(g);△H=-905kJ/mol①
4NH3(g)+3O2(g)2N2(g)+6H2O(g);△H=-1268kJ/mol②;
依据盖斯定律①-②得到,2N2(g)+2O2(g)=4NO(g)△H=+363KJ/mol,则氮气氧化为NO的热化学方程式为:N2(g)+O2(g)2NO(g);△H=+181.5 kJ/mol,故D错误;本题选A。

 阅读快车系列答案
阅读快车系列答案【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 压强 | CO2与CO的物质的量之比 |
B | 温度 | 容器内混合气体的密度 |
C | MgSO4的质量(忽略体积) | CO的转化率 |
D | SO2的浓度 | 平衡常数K |
A. A B. B C. C D. D
【题目】非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛。
⑴ O2-的电子式为___________;
⑵ O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例________(写化学式,任写两种);
⑶ CH3OH在常温下为液态,沸点高于乙烷的主要原因是__________________________;
⑷ Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
危险性 |
|
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
包装 | 钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用____________________________。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是_________________。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中
c(Cl-) : c(ClO-)=11 : 1时,则c(ClO-) :c(ClO3-)比值等于_____________。
⑸ 镁是一种较活泼的金属, Mg与Ca类似,也能与C形成某种易水解的离子化合物。已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体。该气体被溴水全部吸收后,溴水增重2.6g。请写出该水解反应方程式___________________________。