题目内容
20.配合物[Cr(H2O)4Br2]Br•2H2O中,中心离子的配位数是6,配离子的电荷数是1.分析 该配合物中中心离子是Cr3+,[Cr(H2O)4Br2]-中的中心离子的配体是H2O、Br,据此分析解答.
解答 解:该配合物中中心离子是Cr3+,[Cr(H2O)4Br2]-中的中心离子的配体是H2O、Br,则中心离子的配位数是6,[Cr(H2O)4Br2]Br•2H2O中外界Br带一个单位负电荷,则配离子带一个单位正电荷,
故答案为:6;1.
点评 本题考查配合物的配离子、配位数等基本理论,明确配合物中外界、內界、配位体等概念即可解答,题目难度不大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
8.下列说法正确的是( )
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热决定于生成物具有的总能量和反应物具有的总能量的大小
⑤反应物的总能量高于生成物的总能量时,发生放热反应
⑥反应物的总能量低于生成物的总能量时,发生吸热反应
⑦化学反应中的能量变化都表现为热量的变化.
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热决定于生成物具有的总能量和反应物具有的总能量的大小
⑤反应物的总能量高于生成物的总能量时,发生放热反应
⑥反应物的总能量低于生成物的总能量时,发生吸热反应
⑦化学反应中的能量变化都表现为热量的变化.
| A. | ①②③④⑤⑥ | B. | ②③ | C. | ②③⑦ | D. | ①④⑤⑥ |
15.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | Na+、Mg2+、MnO4-、SO42- | B. | NH4+、Al3+、NO3-、Cl- | ||
| C. | K+、Na+、AlO2-、NO3- | D. | Mg2+、K+、HCO3-、OH- |
5.有Xn+、Ym+、Zn-,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数.若按X→Y→Z的顺序,下列说法中正确的是( )
| A. | 它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强 | |
| B. | 它们的原子半径依次增大 | |
| C. | 它们的单质在常温.常压下的密度依次减小 | |
| D. | 它们的最高价氧化物的水化物都是强电解质 |
12.下面用轨道表示式表示原子的价电子排布正确的是( )
| A. |  | B. | 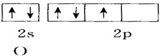 | ||
| C. | 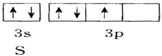 | D. | 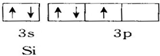 |
10.硫酸铜、硝酸铁都是重要的化工原料.
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:
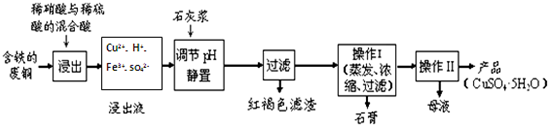
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:
①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硝酸铜的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验.5min后可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是Fe(NO3)3在H2O2分解反应中起催化作用.从图a知H2O2的分解反应为放热反应,从图b也知2NO2?N2O4反应为放热反应,B瓶中H2O2在Fe(NO3)3催化剂的作用下分解快,相同时间内放热多,因此B瓶所处温度高,2NO2?N2O4平衡逆向移动,NO2浓度大,颜色深.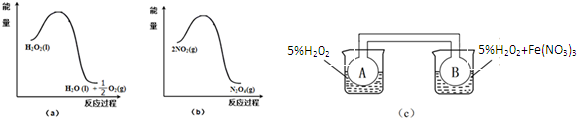
(1)以下是某工厂用含铁的废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
①红褐色滤渣的主要成分是Fe(OH)3;
②写出浸出过程中生成硝酸铜的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
③操作I的温度应该控制在100℃左右;
④从溶液中分离出硫酸铜晶体的操作II应为将热溶液冷却结晶、过滤、洗涤、干燥.
(2)某兴趣小组在实验室利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行Fe(NO3)3对H2O2分解速率影响的实验.5min后可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是Fe(NO3)3在H2O2分解反应中起催化作用.从图a知H2O2的分解反应为放热反应,从图b也知2NO2?N2O4反应为放热反应,B瓶中H2O2在Fe(NO3)3催化剂的作用下分解快,相同时间内放热多,因此B瓶所处温度高,2NO2?N2O4平衡逆向移动,NO2浓度大,颜色深.

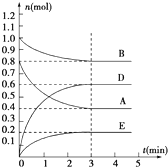 在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:
在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示: