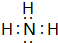��Ŀ����
9�� A��B��C��DΪԭ�������������������Ԫ�أ�A2-��B+������ͬ�ĵ��ӹ��ͣ�C��DΪͬ����Ԫ�أ�C�������������������������3����DԪ���������һ��δ�ɶԵ��ӣ��ش��������⣺
A��B��C��DΪԭ�������������������Ԫ�أ�A2-��B+������ͬ�ĵ��ӹ��ͣ�C��DΪͬ����Ԫ�أ�C�������������������������3����DԪ���������һ��δ�ɶԵ��ӣ��ش��������⣺��1������Ԫ���е縺��������O����Ԫ�ط��ţ�������Cԭ�ӵĺ�������Ų���ʽΪ1s22s22p63s23p3��
��2������A������ͬ�������壬���зе�ߵ���O3�������ʽ����ԭ����O3���ԭ�������ϴ��»����ϴ�A��B���⻯�������ľ������ͷֱ�Ϊ���Ӿ�������Ӿ��壮
��3��C��D��Ӧ��������ɱ�Ϊ1��3�Ļ�����E��E�����幹��Ϊ�����Σ�����ԭ�ӵ��ӻ��������Ϊsp3��
��4������D��ʪ���Na2CO3��Ӧ���Ʊ�D2A���仯ѧ����ʽΪ2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl����2Cl2+Na2CO3=Cl2O+CO2+2NaCl����
��5��A��B�ܹ��γɻ�����F���侧���ṹ��ͼ��ʾ�������߳�a=0.566��10-7cm��F �Ļ�ѧʽΪNa2O��������A ԭ�ӵ���λ��Ϊ8����ʽ���㾧��F���ܶȣ�g•cm-3��Ϊ2.27g•cm-3��
���� C�������������������������3����ӦΪPԪ�أ�C��DΪͬ����Ԫ�أ���ӦΪ��������Ԫ�أ�DԪ���������һ��δ�ɶԵ��ӣ�ӦΪClԪ�أ�A2-��B+������ͬ�ĵ��ӹ��ͣ����ԭ��������ϵ��֪AΪOԪ�أ�BΪNaԪ�أ�
��1��ͬ����������ҵ縺������ClԪ������������Ԫ�ر��ָ��ۣ�����Ԫ�ص縺������ΪOԪ�أ�CΪPԪ�أ�ԭ�Ӻ��������Ϊ15�������������ԭ��ԭ����д��������Ų�ʽ��
��2��AΪOԪ�أ���O2��O3����ͬ�������壬�����ڷ��Ӿ��壬���ԭ������Խ�е�Խ�ߣ�
A��B���⻯��ֱ�ΪH2O��NaH��ǰ��Ϊ���Ӿ��塢����Ϊ���Ӿ��壻
��3��C��D������ɱ�Ϊ1��3�Ļ�����EΪPCl3������Pԭ�Ӽ۲���Ӷ������µ��Ӷ�����ȷ���ӻ���ʽ��ռ乹�ͣ�
��4��������D2AΪCl2O��������ʪ���Na2CO3��Ӧ�õ�Cl2O���ɵ���ת���غ��֪���ȵõ�HCl���ɣ�HCl����̼���Ʒ�Ӧ��
��5��A��B�ܹ��γɻ�����FΪ���ӻ����������λ�ھ����Ķ�������ģ�������λ�ھ��������ģ���Na�ĸ���Ϊ8��O�ĸ���Ϊ8��$\frac{1}{8}$+6��$\frac{1}{2}$=4��N��Na����N��O��=2��1�����γɵĻ�����ΪNa2O���ɾ����ṹ��֪Bԭ����λ��Ϊ4����ϻ�ѧʽ���Լ���Aԭ����λ��������������������ɼ����ܶȣ�
��� �⣺C�������������������������3����ӦΪPԪ�أ�C��DΪͬ����Ԫ�أ���ӦΪ��������Ԫ�أ�DԪ���������һ��δ�ɶԵ��ӣ�ӦΪClԪ�أ�A2-��B+������ͬ�ĵ��ӹ��ͣ����ԭ��������ϵ��֪AΪOԪ�أ�BΪNaԪ�أ�
��1��ͬ����������ҵ縺������ClԪ������������Ԫ�ر��ָ��ۣ�����Ԫ�ص縺������ΪOԪ�أ�CΪPԪ�أ�ԭ�Ӻ��������Ϊ15�������������ԭ��ԭ������������Ų�ʽΪ��1s22s22p63s23p3��
�ʴ�Ϊ��O��1s22s22p63s23p3��
��2��AΪOԪ�أ���O2��O3����ͬ�������壬���߶�Ӧ�ľ��嶼Ϊ���Ӿ��壬��O3���ԭ�������ϴ��»����ϴе�ϸߣ�A���⻯��ΪH2O�����ڷ��Ӿ��壬B���⻯��ΪNaH���������Ӿ��壬
�ʴ�Ϊ��O3��O3���ԭ�������ϴ��»����ϴ��Ӿ��壻���Ӿ���
��3��C��D������ɱ�Ϊ1��3�Ļ�����EΪPCl3��P�γ�3���ļ����µ��Ӷ���Ϊ$\frac{5-1��3}{2}$=1����Ϊsp3�ӻ������幹��ΪΪ�����Σ�
�ʴ�Ϊ�������Σ�sp3��
��4��������D2AΪCl2O��������ʪ���Na2CO3��Ӧ�õ�Cl2O���ɵ���ת���غ��֪���ȵõ�HCl���ɣ�HCl����̼���Ʒ�Ӧ����Ӧ�ķ���ʽΪ��2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl����2Cl2+Na2CO3=Cl2O+CO2+2NaCl����
�ʴ�Ϊ��2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl����2Cl2+Na2CO3=Cl2O+CO2+2NaCl����
��5��A��B�ܹ��γɻ�����FΪ���ӻ����������λ�ھ����Ķ�������ģ�������λ�ھ��������ģ���Na�ĸ���Ϊ8��O�ĸ���Ϊ8��$\frac{1}{8}$+6��$\frac{1}{2}$=4��N��Na����N��O��=2��1�����γɵĻ�����ΪNa2O��
�ɾ����ṹ��֪B��O��ԭ����λ��Ϊ4����ϻ�ѧʽ��֪A��Na��ԭ����λ��Ϊ4��2=8��
����������Ϊ$\frac{4��62g/mol}{6.02��1{0}^{23}mo{l}^{-1}}$�����������Ϊ��0.566��10-7��cm3������F���ܶ�Ϊ$\frac{4��62g/mol}{6.02��1{0}^{23}mo{l}^{-1}}$�£�0.566��10-7��cm3=2.27g•cm-3��
�ʴ�Ϊ��Na2O��8��2.27g•cm-3��
���� �����Ƕ����ʽṹ�����ʵĿ��飬�漰��������Ų����е�Ƚϡ��ӻ���ʽ��ռ乹���жϡ���ѧ����ʽ��д����������ȣ����ؿ���ѧ���ķ��������������������Ѷ��еȣ�

| A�� | ������ˮ�����в��漰��ѧ�仯 | |
| B�� | ��ͬ��Ԫ����ɵ�����һ���Ǵ����� | |
| C�� | �绯��ʯ�ͷ���͵���������������仯 | |
| D�� | Ϊ��ȥ��������Һ��������NaCl���������������ķ��� |
| A�� | 4.3 | B�� | 5 | C�� | 6.3 | D�� | 3.3 |
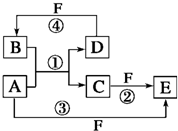 A��B��C��D��E��F�������ʵ�ת����ϵ��ͼ��ʾ����Ӧ�����Ͳ��ֲ���δ�����
A��B��C��D��E��F�������ʵ�ת����ϵ��ͼ��ʾ����Ӧ�����Ͳ��ֲ���δ�����
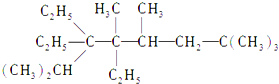 2��2��4��5��7��7-����-3��3��4-�һ����飬
2��2��4��5��7��7-����-3��3��4-�һ����飬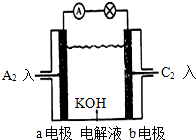 ����A��B��C��D��E���ֶ�����Ԫ�أ���֪����Ԫ�ص�ԭ��������A��B��C��D��E��������ԭ�Ӱ뾶��D��E��B��C��A˳�����μ�С����A��Dͬ���壬A������Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ���ͨ��״���£�A2��B2��C2���ֵ��ʾ�Ϊ������ɫ���壻��B��D��E���ߵ�����������Ӧ��ˮ��������Ϊ�ס��ҡ�������������֮����ɷ�Ӧ���ɿ������κ�ˮ�����������о���CԪ�أ�����д���пհף�
����A��B��C��D��E���ֶ�����Ԫ�أ���֪����Ԫ�ص�ԭ��������A��B��C��D��E��������ԭ�Ӱ뾶��D��E��B��C��A˳�����μ�С����A��Dͬ���壬A������Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ���ͨ��״���£�A2��B2��C2���ֵ��ʾ�Ϊ������ɫ���壻��B��D��E���ߵ�����������Ӧ��ˮ��������Ϊ�ס��ҡ�������������֮����ɷ�Ӧ���ɿ������κ�ˮ�����������о���CԪ�أ�����д���пհף�