题目内容
19.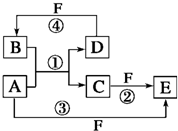 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)(1)若A为常见的金属单质,D、F是气体且F的颜色为黄绿色,反应①在水溶液中进行.则①B为HCl(填化学式).
②写出能够证明氧化性F>E的离子反应方程式为2Fe 2++Cl2=2Fe3++2Cl-.
(2)若A为短周期金属单质,D为短周期非金属单质,且所含的原子序数A是D的2倍,F的浓溶液与A、D反应都有红棕色气体G产生,则:
①A、B分别为:AMg、BCO2.
②若将一充满XmLG和氧气混合气体的大试管倒立于水中,充分反应后,在相同条件下测得试管中余下YmL气体,则原混合气体中G和氧气的体积可能为:G0.8(X-Y)mL或(0.8X+0.6Y)mL,氧气:(0.2X+0.8Y)mL或(0.2X-0.6Y)mL.
分析 (1)若A为常见的金属单质,D、F是气体,且F的颜色为黄绿色,则F是Cl2,根据题中各物质转化关系,则A是Fe,B是HCl、C是FeCl2、D是H2、E是FeCl3,代入题中框图,符合各物质转化关系;
(2)F的浓溶液与A、D反应都有红棕色气体G产生,则G为NO2,F是HNO3,D为短周期非金属单质,则D是C元素;A为短周期金属单质,且所含元素的原子序数A是D的2倍,则A是Mg,B能和Mg反应生成碳单质,则B是CO2,C是MgO,MgO和硝酸反应生成Mg(NO3)2和H2O,Mg和硝酸反应生成Mg(NO3)2,则E是Mg(NO3)2,再结合题目分析解答.
解答 解:(1)若A为常见的金属单质,D、F是气体,且F的颜色为黄绿色,则F是Cl2,根据题中各物质转化关系,则A是Fe,B是HCl、C是FeCl2、D是H2、E是FeCl3,代入题中框图,符合各物质转化关系,
①根据上面的分析可知,B为HCl,
故答案为:HCl;
②氯气氧化亚铁离子生成铁离子,能说明明氧化性氯气>铁离子,反应的离子反应方程式为2Fe 2++Cl2=2Fe3++2Cl-,
故答案为:2Fe 2++Cl2=2Fe3++2Cl-;
(2)F的浓溶液与A、D反应都有红棕色气体G产生,则G为NO2,F是HNO3,D为短周期非金属单质,则D是C元素;A为短周期金属单质,且所含元素的原子序数A是D的2倍,则A是Mg,B能和Mg反应生成碳单质,则B是CO2,C是MgO,MgO和硝酸反应生成Mg(NO3)2和H2O,Mg和硝酸反应生成Mg(NO3)2,则E是Mg(NO3)2,
①根据上面的分析可知,A是Mg,B是CO2,
故答案为:Mg;CO2;
②若将一充满XmLNO2和O2混合气体的大试管倒立于水中,充分反应后,在相同条件下测得试管中余下YmL气体,可能为NO也可能为O2,若余下YmL气体O2,则根据反应4NO2+2H2O+O2=4HNO3,可知参加反应的NO2的体积为0.8(X-Y)mL,氧气的体积为YmL+0.2(X-Y)mL=(0.2X+0.8Y)mL,所以原混合气体中NO2的体积为0.8(X-Y)mL,氧气的体积为(0.2X+0.8Y)mL;若余下YmL气体NO,则余下的NO2的体积为3YmL,根据反应4NO2+2H2O+O2=4HNO3,可知参加反应的NO2的体积为0.8(X-3Y)mL,氧气的体积为0.2(X-3Y)mL,所以原混合气体中NO2的体积为3YmL+0.8(X-3Y)mL=(0.8X+0.6Y)mL,氧气的体积为(0.2X-0.6Y)mL,
故答案为:NO2:0.8(X-Y)mL,O2:(0.2X+0.8Y)mL或NO2:(0.8X+0.6Y)mL,O2:(0.2X-0.6Y)mL.
点评 本题考查无机物的推断、常用化学用语等,为高频考点,涉及常见元素及其化合物知识的考查,把握元素的位置及单质的性质来分析推断各物质,注意根据物质的特殊元素、物质结构、物质之间的转化关系进行推断,熟悉常见单质及其化合物的性质是解本题关键,题目难度中等.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置:
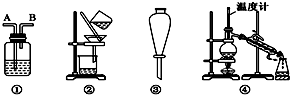
| 选项 | 物质 | 试剂 | 装置 |
| A | C2H6(C2H4) | ⑥ | ① |
| B | 苯(苯酚) | ① | ③ |
| C | CH3COOC2H5(CH3COOH) | ③ | ② |
| D | 甲苯(二甲苯) | ① | ③ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 煤的液化、气化是物理变化,煤的干馏是化学变化 | |
| B. | 蛋白质、淀粉、纤维素、油脂均属于高分子化合物 | |
| C. | 乙酸乙酯在碱性条件下的水解反应属于皂化反应 | |
| D. | 石油裂化的目的是为了提高汽油等轻质液态油的产量和质量 |
| A. | 糖类、油脂、蛋白质都是由C、H、O元素构成的高分子化合物 | |
| B. | 淀粉和纤维素的分子式完全相同,它们互为同分异构体 | |
| C. | 油脂、蛋白质在一定条件下都可以发生水解,但水解产物不同 | |
| D. | 煤的液化和气化都是物理变化,以重油为原料裂解可得到各种轻质油 |
| A. | 常温常压下32g O2和O3所含的原子数为2NA | |
| B. | 标准状况下22.4L CCl4所含的分子数为NA | |
| C. | 1mol/L CaCl2溶液中所含的Cl-离子数为2NA | |
| D. | 56 g Fe与任何物质完全反应时转移的电子数一定为2NA |
| 物质 | 杂质 | 除杂质的方法 | |
| A | SiO2 | CaCO3 | 过量稀硫酸、过滤 |
| B | 铜粉 | 铝粉 | 过量CuCl2溶液、过滤 |
| C | FeCl3溶液 | FeCl2 | 通入适量氯气 |
| D | SO2 | HC1 | 通过NaHSO3溶液的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 只能从动植物等有机体中取得的化合物称为有机物 | |
| B. | 乙烯、苯、环己烷都属于脂肪烃 | |
| C. | 含有苯环的有机物称为芳香烃 | |
| D. | 仅含碳氢元素的有机化合物称为烃 |
 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题: