题目内容
19. 现有A、B、C、D、E五种短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素;③通常状况下,A2、B2、C2三种单质均为常见无色气体;④B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素.请填写下列空白:
现有A、B、C、D、E五种短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素;③通常状况下,A2、B2、C2三种单质均为常见无色气体;④B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素.请填写下列空白:(1)BA3的电子式
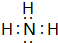
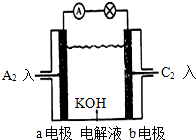
(2)将A2、C2按图所示通入某燃料电池中,其中,b电极为正极(填“正”或“负”),电极反应式为O2+4e-+2H2O=4OH-.
(3)E单质与乙的溶液反应生成物质丁和A2气体,写出反应的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑
(4)用石墨作电极,电解上述丁的水溶液500mL,两极产生气泡.持续电解一段时间后停止通电,在整个过程中阳极附近的溶液还可观察到的现象是有白色沉淀产生,又逐渐溶解:解释此现象的离子方程式是AlO2-+H++H2O=Al(OH)3↓\Al(OH)3+3H+=Al3++3H2O当电路中通过amol电子时,阴、阳两极共产生气体16.8aL(标准状况).
分析 现有A、B、C、D、E五种短周期元素,A是所有元素中原子半径最小的元素,则A为H元素;A、D同主族,原子序数形成大于2,故D为Na;通常状况下,A2、B2、C2三种单质均为常见无色气体,C的原子序数大于B,故B为N元素、C为O元素;B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,应是氢氧化铝、强酸、强碱之间的反应,故E为Al元素,据此解答.
解答 解:现有A、B、C、D、E五种短周期元素,A是所有元素中原子半径最小的元素,则A为H元素;A、D同主族,原子序数形成大于2,故D为Na;通常状况下,A2、B2、C2三种单质均为常见无色气体,C的原子序数大于B,故B为N元素、C为O元素;B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,应是氢氧化铝、强酸、强碱之间的反应,故E为Al元素.
(1)BA3为NH3,电子式为: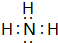 ,故答案为:
,故答案为: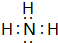 ;
;
(2)将H2、O2按图所示通入某燃料电池中,氧气发生还原反应,故b电极为正极,电极反应式为 O2+4e-+2H2O=4OH-,
故答案为:正;O2+4e-+2H2O=4OH-;
(3)Al与NaOH的溶液反应生成物质丁和H2气体,反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(4)用石墨作电极,电解上述NaAlO2的水溶液500mL,两极产生气泡,阳极是氢氧根离子放电生成氧气,阴极是氢离子放电生成氢气,阳极还会发生反应:AlO2-+H++H2O=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,持续电解一段时间后停止通电,在整个过程中阳极附近的溶液还可观察到的现象是:有白色沉淀产生,又逐渐溶解,发生总反应为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,当电路中通过amol电子时,阴、阳两极共产生气体为3mol×$\frac{amol}{4mol}$=0.75amol,体积为0.75amol×22.4L/mol=16.8a L,
故答案为:有白色沉淀产生,又逐渐溶解;AlO2-+H++H2O=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O;16.8a.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语及原电池、电解池的考查,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. |  充电器给手机充电 | B. |  太阳能交通信号灯 | ||
| C. |  电饭煲煮饭 | D. |  天然气汽车 |
| A. | 天然气的主要成分是CH4 | |
| B. | 浓硫酸具有吸水性、脱水性、强氧化性 | |
| C. | 淀粉、纤维素、蚕丝、油脂都是高分子化合物 | |
| D. | 工业上采用电解熔化的氧化铝的方法来制备金属铝 |
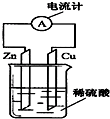 如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录:实验后的记录:①Cu为负极,发生氧化反应; ②H+向负极移动; ③Cu电极上有气泡产生;④电子流动方向是Zn→导线→Cu.描述合理的是( )
如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录:实验后的记录:①Cu为负极,发生氧化反应; ②H+向负极移动; ③Cu电极上有气泡产生;④电子流动方向是Zn→导线→Cu.描述合理的是( )| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
| A. | N2 | B. | CO2 | C. | H2 | D. | O2 |
已知:①P4(g)+6Cl2(g)═4PCl3(g)△H=a kJ•mol-1
P4(g)+10Cl2(g)═4PCl5(g)△H=b kJ•mol-1
②几种化学键的键能数据如下(键能指断裂1mol气态化学键生成气态原子吸收的能量)
| 化学键 | Cl-Cl | PCl3中P-Cl键 | PCl5中P-Cl键 |
| 键能/kJ•mol-1 | d | 1.2c | c |
(1)断裂1mol PCl5(g)中化学键吸收能量比断裂1mol PCl3(g)中化学键吸收能量多0.2c.
(2)1mol P4分子中含有6mol P-P键,P-P键的键能为(a-6d+4.8c)kJ•mol-1.
(3)分开上述数据,能否计算Cl2(g)+PCl3(g)═PCl5(g)的反应热△H?若不能计算,缺什么数据?
| A. | 若已知上述反应为放热反应,升高温度,其平衡常数减小 | |
| B. | 上述反应中每生成1molSi3N4,转移12mol电子 | |
| C. | 在氮化硅的合成反应中,N2是氧化剂,SiO2是还原剂 | |
| D. | 若使压强增大,上述平衡向逆反应方向移动 |
 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题: