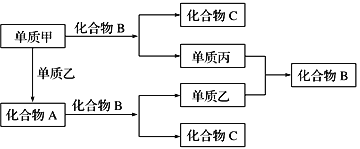
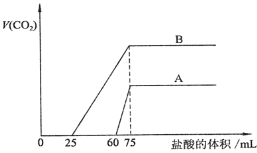
题目内容
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程:
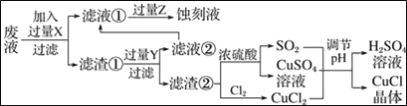
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X_______,Y________
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是_________________;生产过程中调节溶液的pH不能过大的原因是__
(3)写出产生CuCl的化学方程式:__________________________________
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是________________________
【答案】Fe稀盐酸减少产品CuCl的损失防止CuCl水解 CuCl2+CuSO4+SO2+2H2O═2CuCl↓+2H2SO4生产中应防止CuCl的氧化和见光分解
【解析】
向工业上以某酸性废液(含Cu2+、Fe3+、H+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,过滤,滤渣为过量的铁和生成的铜,滤液为氯化亚铁溶液;依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,滤液为氯化亚铁溶液;滤液中通入氯气,氯化亚铁溶液与氯气反应生成氯化铁溶液,氯化铁溶液可以做刻蚀液;滤渣一部分与氯气反应生成氯化铜,一部分与浓硫酸反应生成硫酸铜和二氧化硫,然后将两者混合,在溶液中氯化铜、硫酸铜、二氧化硫反应生成氯化亚铜和硫酸。
(1)根据流程图可知废渣①中含有铜,这说明X应该是铁,将溶液中的铜离子置换出来。同时溶液中的铁离子也氧化铁,因此废液①的主要含有的金属阳离子是Fe2+;在反应中铁是过量的,则废渣①的主要含有的物质是Fe和Cu;Y能溶解废渣①中的铁,这说明Y应该是盐酸。(2)氯化亚铜微溶于水、不溶于乙醇及稀硫酸,因此应该用乙醇洗涤,选择乙醇洗涤CuCl晶体,有利加快去除CuCl表面水分,防止其水解氧化,减少CuCl的损失;pH过大,则溶液碱性过强,可能导致氯化亚铜水解程度增大,生成氢氧化铜沉淀。(3)氯化铜与硫酸铜、二氧化硫反应生成氯化亚铜、硫酸,反应的化学方程式为CuCl2+CuSO4+SO2+2H2O═
2CuCl↓+2H2SO4。(4)由题给“在空气中迅速被氧化成绿色;见光则分解,变成褐色”可知,制备过程中应防止CuCl的氧化和见光分解。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】钼是一种重要的过渡金属元素,通常用作合金及不锈钢的添加剂,可增强合金的强度、硬度、可焊性等。钼酸钠晶体(Na2MoO4·2H2O)可作为无公害型冷却水系统的金属腐蚀抑制剂,如图15是化工生产中以辉钼矿(主要成分为硫化钼MoS2)为原料来制备金属钼、钼酸钠晶体的主要流程图。
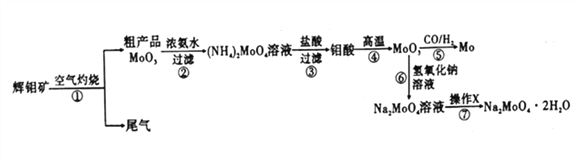
回答下列问题:
(1)已知反应③为复分解反应,则钼酸中钥的化合价为___________。
(2)反应⑥的离子方程式为___________。
(3)辉钼矿灼烧时的化学方程式为____________。
(4)操作X为_________。已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X中应控制温度的最佳范围为_______(填序号)。
温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 | ||||||
溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0℃~10℃ B.10℃~100℃ C.15.5℃~50℃ D.100℃以上
(5)制备钼酸钠晶体还可用通过向精制的辉钼矿中直接加入次氯酸钠溶液氧化的方法,若氧化过程中,还有硫酸钠生成,则氧化剂与还原剂的物质的量之比为_________。
(6)Li、MoS2可充电电池的工作原理为xLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
(7)可用还原性气体(CO和H2)还原MoO3制钼,业上制备还原性气体CO和H2的反应原理之一为CO2+CH4![]() 2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2还原MoO3制钼,理论上能生产钼的质量为_________。
2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2还原MoO3制钼,理论上能生产钼的质量为_________。