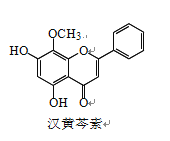
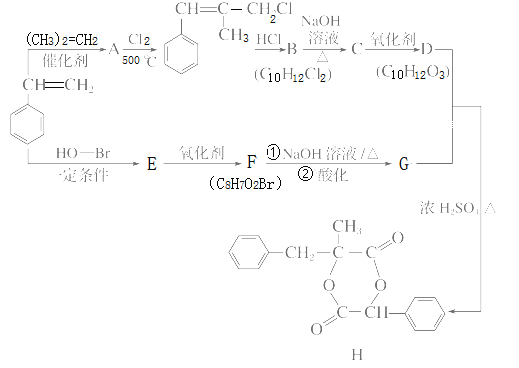
题目内容
【题目】向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
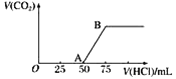
A. OA段所发生反应的离子方程式:H++OH-===H2O
B. NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1
C. 产生的CO2体积(标准状况下)为0.056 L
D. 稀释液中NaOH的物质的量浓度为0.025 mol·L-1
【答案】A
【解析】
A.根据图像可知在A~B段发生反应:HCO3-+H+===H2O+CO2↑;则产生HCO3-的反应:CO32-+H+===HCO3-;二者反应消耗的酸的物质的量相等,由于气体达到最大消耗的盐酸是25 mL,则产生HCO3-的反应也消耗盐酸25 mL,因此在O~A段发生反应是H++OH-===H2O、CO32-+H+===HCO3-;故A分析错误;
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,根据消耗的HCl的物质的量的关系可知二者的物质的量的比是1∶1,由于溶质处于同一溶液,所以其物质的量浓度之比为1∶1,故B分析正确;
C.n(CO2)=n(HCl)=0.1mol·L-1×0.025L=0.0025mol,在标准状况下产生的CO2体积是V(CO2)= 0.0025 mol×22.4 L·mol-1=0.056 L,故C分析正确;
D.HCl+NaOH===NaCl+H2O,n(NaOH)=n(HCl)=0.1mol·L-1×0.025L=0.0025mol;c(NaOH)·V(NaOH)=n(NaOH)= 0.002 5 mol;c(NaOH)= 0.002 5 mol÷0.1 L=0.025 mol·L-1,故D分析正确;
答案选A。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图____________。
(2)写出Y元素最高价氧化物的水化物与NaOH溶液反应的离子方程式______________
(3)写出Y的价电子排布式_________________________。
(4)元素T与氯元素相比,非金属性较强的是_______(用元素符号表示),下列表述中能用于证明这一事实的是_______(填字母代号)。
A.气态氢化物的挥发性 B.两元素的电负性
C.含氧酸的酸性 D.氢化物中X—H键的键长(X代表T和Cl两种元素)
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是___(填元素符号)