题目内容
C、N、O是中学化学常见的三种元素,请回答下列问题:
(1)写出基态O2-的核外电子排布式______________________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为_____________________________。
(3)光气(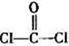 )分子中含有______个
)分子中含有______个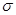 键,____个
键,____个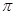 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。
(4)水的熔点比H2S的熔点高,其原因是________________。
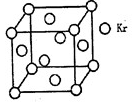
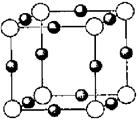
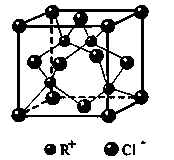
(5)超硬材料氮化销的晶胞如图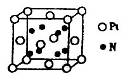 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。
(1)写出基态O2-的核外电子排布式______________________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为_____________________________。
(3)光气(
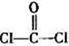 )分子中含有______个
)分子中含有______个 键,____个
键,____个 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。(4)水的熔点比H2S的熔点高,其原因是________________。
(5)超硬材料氮化销的晶胞如图
 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。(除注明外,每空1分,共8分)(1)1s22s22p6 (2)3;1;sp2
(4)H2O分子间形成氢键 (5)PtN2
(4)H2O分子间形成氢键 (5)PtN2
试题分析:(1)O2-核外有10个电子,根据构造原理可知,其核外电子排布式为1s22s22p6。
(2)同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C。由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由大到小的顺序为N<O<C。
(3)单键都是σ 键,双键是由一个σ 键和1个π键构成的。所以根据光气的结构式可知,光气分子中含有3σ键,一个π键,碳原子含有3个σ 键且不含孤电子对,所以其杂化方式为sp2。
(4)O、S属于同一主族元素,硫化氢的相对分子质量大于水,但水中含有氢键,导致水的熔点比H2S的熔点高。
(5)根据晶胞结构并依据均摊法可知,N原子个数=8个,Pt原子个数=8×
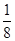 +6×
+6×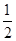 =4个,所以其化学式为PtN2。
=4个,所以其化学式为PtN2。
练习册系列答案
相关题目
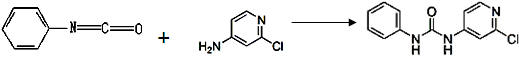
 ,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。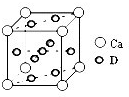
 ,该氯化物的化学式为__________。
,该氯化物的化学式为__________。