题目内容
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的最高价含氧酸根离子中其中心原子采取 杂化。
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有 。
(4)基态D原子的核外电子排布式为 ,下图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为 。
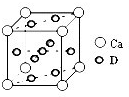
(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现沉淀,最后沉淀溶解形成溶液。写出此沉淀溶解的离子方程式:_ ___。
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的最高价含氧酸根离子中其中心原子采取 杂化。
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有 。
(4)基态D原子的核外电子排布式为 ,下图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为 。

(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现沉淀,最后沉淀溶解形成溶液。写出此沉淀溶解的离子方程式:_ ___。
(8分)(1)C<O<N(2分) (2)sp2(1分) (3)N2或CO(1分,其它合理答案也给分)
(4)1s22s22p63s23p63d104s1(或[Ar] 3d104s1)(1分);1:5(1分)
(5)Cu(OH)2+4NH3?H2O=[Cu(NH3)]2++2OH-+4H2O(2分)
(4)1s22s22p63s23p63d104s1(或[Ar] 3d104s1)(1分);1:5(1分)
(5)Cu(OH)2+4NH3?H2O=[Cu(NH3)]2++2OH-+4H2O(2分)
试题分析:A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大, B原子的最外层p轨道的电子为半充满结构,最外层电子排布为2s22p3,故B为氮元素。第二周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s22s1或1s22s22p2,结合(3)能与N元素形成阴离子(AN-),故A为碳元素;C是地壳中含量最高的元素,所以C是氧元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素。(1)C、N、O元素是同一周期元素,同一周期元素自左向右非金属性逐渐增强,第一电离能呈增大趋势。但由于氮元素原子2p能级是半充满稳定状态,能量较低,所以第一电离能高于同周期相邻元素,故第一电离能由小到大的顺序为C<O<N。
(2)A的最高价含氧酸根离子是CO32-,根据价层电子对互斥理论可知,其中碳原子含有的孤对电子对数=(4+2-3×2)÷2=0,这说明碳原子最外层电子数全部成键,没有孤电子对,杂化轨道数目为3,采取sp2杂化。
(3)原子数和价电子数分别都相等的是等电子体,因此将CN-中碳原子及1个负电荷换成1个氮原子,可得的等电子体N2,将N原子及1个负电荷换成1个O原子,可得的等电子体CO,即互为等电子体的是N2或CO。
(4)D的原子序数是29,为Cu元素,根据构造原理可知,其原子核外电子排布式为1s22s22p63s23p63d104s1。由晶胞结构可知,Ca原子处于顶点,所以根据均摊法可知晶胞中含有Ca原子数目为8×
 =1个。Cu原子处于晶胞内部与面上、面心处,所以晶胞中Cu数目为1+4×
=1个。Cu原子处于晶胞内部与面上、面心处,所以晶胞中Cu数目为1+4×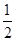 +4×
+4×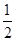 =5个,故该合金中Ca和Cu的原子个数比为1:5。
=5个,故该合金中Ca和Cu的原子个数比为1:5。(5)将氨水滴加到硫酸铜溶液中,首先反应生成氢氧化铜沉淀,继续滴加氨水,氢氧化铜与氨水反应生成四氨合铜络离子,反应的离子方程式为Cu(OH)2+4NH3?H2O=[Cu(NH3)]2++2OH-+4H2O。

练习册系列答案
相关题目
 2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。
2NH3实现储氢和输氢。下列说法正确的是________(多项选择)。


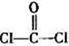 )分子中含有______个
)分子中含有______个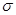 键,____个
键,____个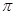 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。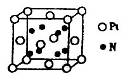 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。