题目内容
金属铜的导电性仅次于银,大量用于电气工业。
(1)写出铜的基态原子价电子电子排布式________。
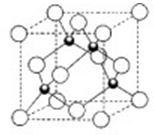
(2)铜的某种氯化物晶体的晶胞结构如右图所示 ,该氯化物的化学式为__________。
,该氯化物的化学式为__________。
(3)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体。氨分子中N原子的杂化方式为__________。上述深蓝色晶体中含有的化学键除普通共价键外,还有________和_____________。
(4)NH3的沸点比pH3大,其原因是________________________________。
(1)写出铜的基态原子价电子电子排布式________。
(2)铜的某种氯化物晶体的晶胞结构如右图所示
 ,该氯化物的化学式为__________。
,该氯化物的化学式为__________。(3)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体。氨分子中N原子的杂化方式为__________。上述深蓝色晶体中含有的化学键除普通共价键外,还有________和_____________。
(4)NH3的沸点比pH3大,其原因是________________________________。
(1)(2分)3d104s1 (2)(1分)CuCl (3)sp3(1分)离子键(1分)配位键(1分)
(4)(2分)NH3分子之间有氢键作用,故沸点明显高于pH3
(4)(2分)NH3分子之间有氢键作用,故沸点明显高于pH3
试题分析:(1)Cu是29号元素,原子核外电子数为29。根据构造原理和洪特规则可知,铜的基态原子价电子电子排布式3d104s1。
(2)由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子属于顶点与面心上。实验依据均摊法可知晶胞中含有Cl原子数目为8×
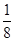 +6×
+6×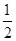 =4,所以两种原子的个数之比是1:1,因此该氯化物的化学式为CuCl。
=4,所以两种原子的个数之比是1:1,因此该氯化物的化学式为CuCl。(3)NH3分子中N原子形成3个N-H键,含有(5-3×1)÷2=1对孤对电子,杂化轨道数目为4,采取sp3杂化;在该晶体中Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,NH3分子中N、H原子之间以共价键结合,[Cu(NH3)4]2+与SO42-以离子键结合。
(4)氮原子电负性较大,导致NH3分子之间有氢键作用,而pH3中不存在氢键,所以NH3的沸点比pH3高。

练习册系列答案
相关题目
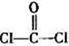 )分子中含有______个
)分子中含有______个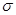 键,____个
键,____个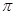 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。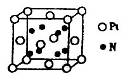 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。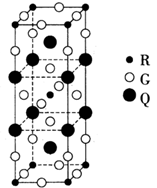



 ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子 Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。