题目内容
5.下列关于中和热测定实验的说法中正确的是( )| A. | 利用该实验的装置可以测定BaSO4的生成热 | |
| B. | 测定强酸强碱的中和热实验需要使用的玻璃仪器有:2 个500mL的烧杯、2个50mL的量筒、温度计 | |
| C. | 若将盐酸改用浓度和体积对应相同的CH3COOH进行实验,测得的△H将会减小 | |
| D. | 中和热测定实验中至少要测定3次温度 |
分析 A.根据测定的原理相同;
B.根据中和热测定实验的过程和仪器分析中和热实验时所需的玻璃仪器;
C.根据弱电解质电离吸热;
D.中和反应之前,分别记录盐酸和氢氧化钠的温度,中和反应开始后,记录下混合溶液的最高温度,即最终温度,所以每一组要记录3次温度,而我们实验时至少要做2组,所以至少要记录6次温度.
解答 解:A.中和热的测定原理与BaSO4的生成热的测定原理相同,利用该实验的装置可以测定BaSO4的生成热,故A正确;
B.中和热的测定实验中需要用的主要玻璃仪器有:2只大小不同的烧杯、2个大小相同量筒、温度计、环形玻璃搅拌捧,故B错误;
C.CH3COOH为弱酸,电离过程为吸热,所以用CH3COOH代替盐酸溶液反应,反应放出的热量偏小,但△H为负值,测得的△H将会偏大,故C错误;
D.在测定中和热的实验中,每一组要记录3次温度,而我们实验时至少要做2组,所以至少要记录6次温度,故D错误.
故选A.
点评 本题主要考查了中和热测定实验的仪器、步骤和原理,难度中等,需要注意的是为了减少实验误差,实验至少要做2组,所以至少要记录6次温度.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
16.0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+.对于该平衡,下列叙述正确的是( )
| A. | 加入水时,溶液中c(H+) 和c(OH-) 都减小 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/L HCl溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
14.现有甲、乙、丙三种元素,其原子序数都不超过20.有关信息如下:
下列关于甲、乙、丙三种元素相关的分析正确的是( )
| 元素代号 | 相关信息 |
| 甲 | n为电子层数,甲原子最外层电子数为(2n2-1) |
| 乙 | 在周期表中它的周期数为k,主族序数为(2k+1) |
| 丙 | 电子层数大于最外层电子数 |
| A. | 甲的单质难溶于水 | |
| B. | 乙的气态氢化物遇湿润的pH试纸变红色或蓝色 | |
| C. | 丙的最高价氧化物对应的水化物是强碱 | |
| D. | 甲、丙只能形成共价化合物 |
10.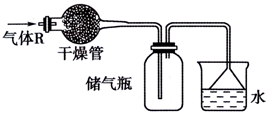 实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )
实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )
 实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )
实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )| A. | NO | B. | HCl | C. | O2 | D. | NH3 |
17.下列实验方案合理的( )
| A. | 向某水溶液中加入氯化钡溶液发现有白色沉淀生成即可证明该溶液中含有硫酸根离子 | |
| B. | 某盐溶液加入盐酸产生二氧化碳,该盐一定为碳酸盐 | |
| C. | 将O2和H2的混合气体通过灼热的CuO,以除去其中的H2 | |
| D. | 加稀盐酸后过滤,以除去混在铜粉中的少量镁粉和铝粉 |
15.下列有关实验现象的描述中,正确的是( )
| A. | 金属钠在氯气中燃烧,有白雾生成 | |
| B. | 铜在氯气中燃烧,生成蓝色的氯化铜颗粒 | |
| C. | 钠投入硫酸铜溶液中,会产生蓝色沉淀 | |
| D. | 钠在空气中燃烧后得到白色粉末状固体 |