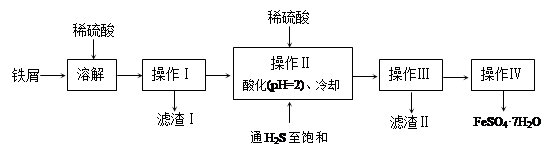题目内容
(1)实验室用二氧化锰跟浓盐酸反应制取氯气的离子方程式为 。
(2)高锰酸钾是常用氧化剂,在酸性条件下,MnO4-被还原成Mn2+,用高锰酸钾跟浓盐酸反应在室温下制氯气的离子方程式为 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为 。
(4)现有100 mL AlCl3与MgSO4的混合溶液,分成两等份。
① 向其中一份中加入10 mL 4 mol/L的氨水,恰好完全沉淀,其中AlCl3与氨水反应的离子方程式是 。继续加入1 mol/L NaOH溶液至10 mL时,沉淀不再减少,沉淀减少的离子方程式是 ,减少的沉淀的物质的量是 。
② 向另一份中加入a mL 1 mol/LBaCl2溶液能使SO42-沉淀完全,a= 。
(14分)(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)
(2)2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O(2分)
(3)4HCl+O2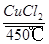 2Cl2↑+2H2O
2Cl2↑+2H2O
(4)①A13+ + 3NH3?H2O=Al(OH)3↓+ 3NH4+ Al(OH)3+ OH-=AlO2-+ 2H2O
0.01 mol
②5
解析试题分析:(1)、实验室常用二氧化锰氧化浓盐酸法制取氯气,在加热时反应生成二氯化锰、氯气和水,化合价升降总数均为2;(2)、高锰酸钾的氧化性比二氧化锰强,常温下能氧化浓盐酸,生成氯化钾、二氯化锰、氯气和水,化合价升降总数均为10;(3)、根据氧化还原反应方程式的配平方法可知,氯化氢气体被氧气催化氧化为氯气和水蒸气,化合价升降总数均为4;(4)、①完全沉淀之前反应式为A13+ + 3NH3?H2O=Al(OH)3↓+ 3NH4+、Mg2++2NH3?H2O=Mg(OH)2↓+ 2NH4+;完全沉淀之后,氢氧化铝是两性氢氧化物,能溶于过量的氢氧化钠溶液,生成偏铝酸盐和水,反应式为Al(OH)3+ OH-=AlO2-+ 2H2O;该反应中两反应物的化学计量数之比等于物质的量之比,由于n(OH-)=n(NaOH)=c?V=1mol/L×0.01L=0.01mol,则n[Al(OH)3]=0.01mol;根据铝元素守恒,由此推断原溶液中n( AlCl3)=n[Al(OH)3]=0.01mol,沉淀之前消耗的n(NH3?H2O)=0.03mol;由于n=cV,则完全沉淀总共消耗的n(NH3?H2O)=4mol/L×0.01L=0.04mol,则被MgSO4消耗的n(NH3?H2O)=0.04mol—0.03mol=0.01mol,根据两反应物的化学计量数之比等于物质的量之比,则n(MgSO4)=0.005mol;②另一等份的混合溶液中也含有0.01mol AlCl3、0.005molMgSO4,前者与BaCl2溶液不反应,后者发生的沉淀反应为MgSO4+BaCl2=BaSO4↓+MgCl2,根据两反应物的化学计量数之比等于物质的量之比,则n(BaCl2)=0.005mol;由于V=n/c,则V=0.005mol÷1 mol/L×1000mL/L=5mL,则a=5。
考点:考查离子方程式、氧化还原反应、氢氧化铝的沉淀和溶解、硫酸盐的沉淀反应的计算等相关知识。

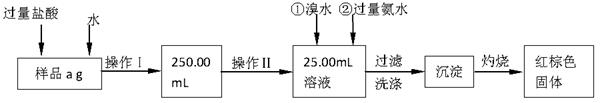
我国化工专家侯德榜发明的侯氏制碱法的化学原理是将二氧化碳通入氨水的氯化钠饱和溶液中,其化学反应方程式为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
(1)在实验室中利用上述原理从反应所得溶液中分离出碳酸氢钠晶体,应选用下列装置中的 。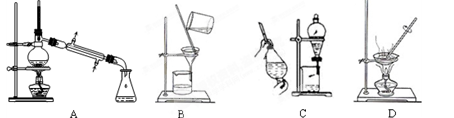
(2)实验所得碳酸氢钠晶体中,可能含有的杂质离子有Cl—和NH4+,实验室鉴定Cl—所选用的试剂是、,鉴定另一种杂质离子的方法是 (填序号)。
| A.加水,将湿润的红色石蕊试纸放在试管口 |
| B.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
| C.加氢氧化钠溶液,加热,滴入酚酞试剂 |
| D.加氢氧化钠溶液,加热,滴入紫色石蕊试剂 |
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
【查阅资料】2KNO3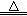 2KNO2+O2↑ Fe(NO3)2
2KNO2+O2↑ Fe(NO3)2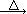 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中铁元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
(1)【提纯猜想】
猜想一:铁元素只显+2价;
猜想二:铁元素 ;
猜想三:铁元素既有+2价又有+3价。
【实验操作】①向一份溶液中滴入KSCN溶液;向另一份溶液中滴入酸性KMnO4稀溶液。
(2)【实验现象】实验① ;实验② 。
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行料如下实验,请完成实验空缺部分内容。限选试剂和用品:浓H2SO4溶液、4mol/LNaOH溶液、0.1mol/LBaCl2溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中,加热分解。 | ,说明分解产生的气体中含有NO2。 |
| 步骤2:将产生的气体依次通过盛有足量 、浓硫酸的洗气瓶, 在最后一个出口检验。 | ,说明分解产生的气体中含O2。 |
实验三:KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:①取混合物样品10g,充分加热分解;②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为3.2g。则混合物中铁元素的质量分数为 。(保留三位有效数字,相对原子质量:Fe-56 O-16)
铁触媒(铁的氧化物)是硫酸工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列装置测定铁触媒的含铁量,确定其组成。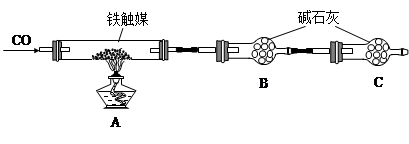
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成。
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)因为通入Cl2不足量,“溶液B”中还含有 会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
| 实验操作 | 实验现象与结论 |
| | |
(4)“干燥管C”的作用是 。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为 。
下列试剂中,不能贮存在玻璃瓶中的是
| A.浓硫酸 | B.氢氟酸 | C.浓氢氧化钠溶液 | D.硝酸银溶液 |
已知乙烯能使酸性高锰酸钾溶液褪色,下列褪色原理与其一致的是( )
| A.SO2使品红溶液褪色 | B.乙烯使溴水褪色 |
| C.SO2使溴水褪色 | D.甲烷使氯气褪色 |