题目内容
三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。该小组同学查阅资料知,固体产物中铁元素不可能以三价形式存在,而盐只有K2CO3,产生的气体中含有CO、CO2。
请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:①蒸馏水②3%H2O2溶液③氧化铜④1.0mol/L盐酸⑤浓硫酸⑥1.0mol/LNaOH溶液⑦澄清石灰水⑧0.5 mol/LCuSO4溶液⑨2%KSCN溶液⑩苯酚溶液
I.若用一套连续实验装置检验气体产物中CO的存在,并验证检验过程中有CO2生成,应选用的试剂为(按先后顺序把所选试剂的标号填入空格内) 。
Ⅱ.探究固体产物中铁元素的存在形式。
(1)提出合理假设
假设1:只有Fe;
假设2:只有FeO;
假设3:
(2)设计实验方案并实验验证
步骤1:取适量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体。
步骤2:取少量上述不溶固体放人试管中,加入足量 溶液,充分振荡。若固体无明显变化,则假设 成立;若有暗红色固体生成,则反应的离子方程式为 。
步骤3:取步骤2所得暗红色固体于试管中,滴加过量 ,振荡后静置。若溶液基本无色,则假设 成立;若溶液呈 ,则假设3成立。
(3)问题讨论
若固体产物中FeO含量较少,用步骤3方法难以确定。请你设计实验方案证明假设3成立(写出实验的操作步骤、现象与结论):
Ⅲ.拓展与延伸
有资料介绍“在含Fe2+的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”。假设溶液中的+3价铁还能被氯水氧化为更高价的FeO42-”,试写出该反应的离子方程式 。
(15分)
Ⅰ.⑥、⑦、⑤、③、⑦
Ⅱ.(1)含有FeO和Fe (1分)
(2)CuSO4溶液(1分) 2 (1分) Fe+Cu2+=Fe2++Cu(2分)
HCl(1分) 1(1分) 浅绿色(1分)
(3)取步骤3静置后的上层清液,滴加几滴KSCN溶液无红色出现,再滴加1-2滴H2O2溶液,充分振荡若溶液变红,则证明假设3成立。(2分,其它合理答案均给分)
Ⅲ.2Fe3++3C12+8H2O=2FeO42-+6Cl-+16H+ (3分)
解析试题分析:
I.CO、CO2的检验该为先检验CO2,将CO2除尽,净化(干燥),检验CO(用CuO,变红),在检验有CO2生成(CO的氧化产物)。
Ⅱ.(1)首先铁不以三价铁形式存在,故考虑范围为二价铁的存在形式,出铁单质,氧化亚铁以为,还有可能就二者的混合物;
(2)由暗红色固体生成,可以确定为Cu,故使用的试剂为CuSO4,然后再暗红色固体(Cu、FeO)中加盐酸,溶液呈无色,说明没有Fe2+(浅绿色),故没有FeO,从而得出结论。
(3)二价铁也氧化为三价铁用KSCN进行检验,该方法比较灵敏
Ⅲ.该反应中告知反应物为Fe3+、Cl2,产物为FeO42-,然后通过氧化还原缺项配平的方法对该反应进行配平,从而得到答案。
考点:本题以探究实验为基础,考查了元素及化合物知识、探究基本方法、氧化还原反应以及实验基础知识(物质的分离、提纯、检验等)。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案某同学用下列装置制备并检验Cl2的性质: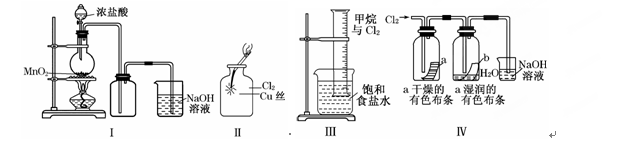
下列说法正确的是( )
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 |
| B.Ⅱ图中:生成蓝色的烟 |
| C.Ⅲ图中:量筒中发生了加成反应 |
| D.Ⅳ 图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
下列说法或做法错误的是
| A.充满NH3的烧瓶倒置于水中后液面迅速上升,说明NH3易溶于水 |
| B.在胆矾中滴加浓H2SO4,固体变白,说明浓H2SO4具有吸水性 |
| C.将二氧化硫通入品红溶液,溶液褪色,加热后能恢复原色 |
| D.向铜粉中加入浓硫酸,加热,铜粉溶解,同时产生H2 |