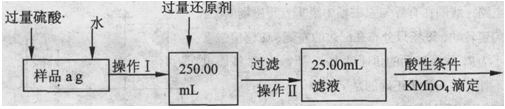
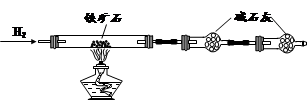题目内容
某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤进行实验: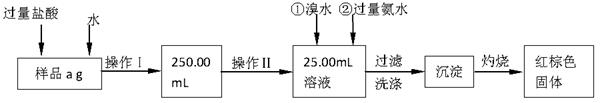
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 。(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热、灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是 ;蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定: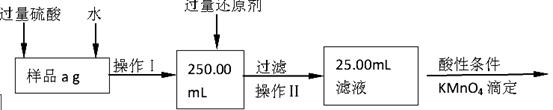
(1)溶解样品改用了硫酸,而不再用盐酸,为什么 ;
(2)选择的还原剂是否能用铁 (填“是”或“否”),原因是:
;
(3)若滴定用掉c mol?L-1 KMnO4溶液b mL,则样品中铁元素的质量分数是: 。
Ⅰ.(1)250mL容量瓶(1分)、胶头滴管(1分)
(2)2Fe 2++ Br2= 2Fe 3++ 2Br-(2分)
(3)再次加热冷却并称量,直至两次质量差小于0.1g(1分)
铁元素的质量分数是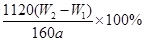 (2分)
(2分)
Ⅱ.(1)过量的盐酸对后面KMnO4的滴定有干扰(2分)
(2)否(1分)如果用铁做还原剂,自身的氧化产物是Fe2+;且会与过量的硫酸反应生成Fe2+,干扰铁元素的测定(2分,答出一个原因即给2分)
(3)铁元素的质量分数是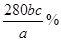 (2分)
(2分)
解析试题分析:I、该实验的原理是:先将样品配成一定浓度的溶液,然后取其中的十分之一,加氧化剂将二价铁氧化为三价铁,然后加碱使铁生成氢氧化铁沉淀,灼烧沉淀使其变为氧化物,通过称量氧化物的质量计算出铁的质量,进而得出铁的质量分数。
(1)配制一定物质的量浓度的溶液所需仪器除了烧杯、玻璃棒外,还需要胶头滴管和容量瓶,由框图中溶液体积为250.00mL,故容量瓶要注明规格。
(2)加入溴水的目的是将二价铁氧化为三价铁,故反应为:2Fe 2++ Br2= 2Fe 3++ 2Br-。
(3)将物质灼烧至恒重的标准是灼烧后连续两次称量质量差小于0.1g,但b1-b2=0.3g,因此还需要继续灼烧,直至两次质量差小于0.1g。灼烧后的固体为Fe2O3,其质量为:(W2—W1)g,其中铁的质量为: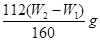 ,该质量为取样的十分之一,因此原样品中铁的质量分数为:
,该质量为取样的十分之一,因此原样品中铁的质量分数为: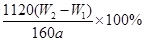 。
。
II、该实验的原理是将样品配成溶液,将其中的三价铁用还原剂还原为二价铁,取其十分之一,再用酸性高锰酸钾滴定二价铁,通过消耗的高锰酸钾的量计算出样品中铁的质量,进而求出铁的质量分数。
(1)盐酸中的Cl—具有还原性,可被高锰酸钾氧化,因此要将盐酸换为硫酸。
(2)若用铁作还原剂,发生的反应为Fe+2Fe3+=3Fe2+,Fe+H2SO4=FeSO4+H2↑,产生的Fe2+会干扰样品中铁的测量。
(3)二价铁被氧化为三价铁,每个Fe失去一个电子,KMnO4被还原为Mn2+,每个KMnO4得到5个电子,因此铁的物质的量是高锰酸钾物质的量的5倍,即n(Fe)=5×10-3bcmol,样品中铁的物质的量为5×10-2bcmol,故样品中铁的质量分数为: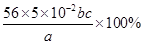 =
=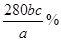 。
。
考点:考查化学实验常用仪器、基本操作,实验原理,实验流程分析,实验数据处理。

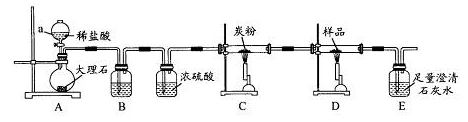
某同学用下列装置制备并检验Cl2的性质: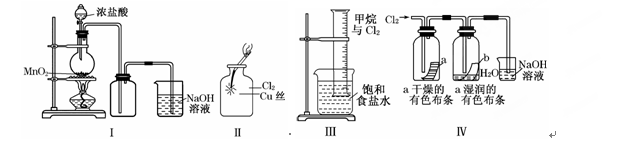
下列说法正确的是( )
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 |
| B.Ⅱ图中:生成蓝色的烟 |
| C.Ⅲ图中:量筒中发生了加成反应 |
| D.Ⅳ 图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是 ( )
| A.①AgNO3;②NaBr;③AgBr | B.①AgNO3;②NaCl;③AgCl |
| C.①AgCl; ②AgNO3;③NaCl | D.①AgNO3;②NaCl;③Ag |
向淀粉溶液中分别加入下列物质,能使溶液变蓝的是
| A.氯水 | B.溴水 | C.碘化钾 | D.碘水 |