题目内容
14.下列物质不是白色固体的是( )| A. | 碳酸钠 | B. | 氢氧化镁 | C. | 过氧化钠 | D. | 氧化铝 |
分析 常见化合物中,铁、铜的化合物一般都有颜色,短周期元素形成的化合物中过氧化钠为淡黄色,以此解答.
解答 解:碳酸钠、氢氧化镁、氧化铝为白色固体,过氧化钠为淡黄色,
故选C.
点评 本题考查元素化合物知识,注意了解常见化学物质的颜色、状态即可正确解决本题,难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
4.如图是氩元素在元素周期表中的具体信息.其中39.95是( )


| A. | 氩的原子序数 | B. | 氩原子的质量数 | ||
| C. | 氩元素的相对原子质量 | D. | 氩原子的相对原子质量 |
2.不属于乙酸化学性质的是( )
| A. | 可与金属钠反应 | B. | 能与碱发生中和反应 | ||
| C. | 可被氧化成乙醛 | D. | 可与乙醇发生酯化反应 |
9.在如图所示的实验装置中,实验进行一段时间后,对观察到的现象叙述不正确的是( )
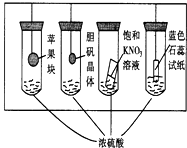

| A. | 苹果块会干瘪 | B. | 胆矾晶体表面有“白斑” | ||
| C. | 小试管内有KNO3晶体析出 | D. | 蓝色石蕊试纸变红 |
19.下列物质的电子式书写正确的是( )
| A. | NaCl Na+${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$ | B. | H2S H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | ||
| C. | N2  | D. | NH4I  |
6.含硒(Se)的保健品已开始进入市场.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A. | 非金属性比硫弱 | B. | 氢化物比HBr稳定 | ||
| C. | 原子序数为34 | D. | 最高价氧化物的水化物显碱性 |
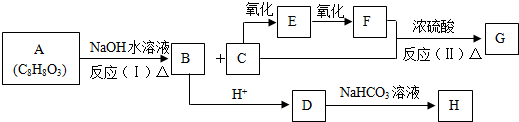
 ;B:
;B: ;E:HCHO G:HCOOCH3
;E:HCHO G:HCOOCH3 .
.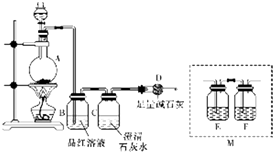 为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.
为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.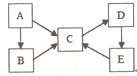 构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系:
构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系: .
.