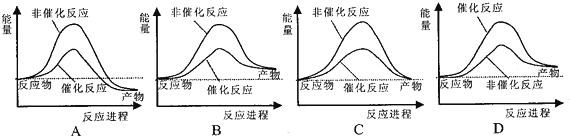
题目内容
2.下列叙述正确的是( )| A. | 某元素基态原最外层有3个未成对电子,最内层有2个电子,其元素符号为N | |
| B. | 某元素的负一价离子的电子层结构与氩相同,其基态原子价电子排布式为[Ne]3s23p5 | |
| C. | 某元素的正三价离子的3d能级为半充满,其基态原子排布式为[Ar]3d64s2 | |
| D. | 某元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,其基态原子的电子排布式为[Ar]3d54s1 |
分析 A、A元素基态原子的最外层有三个未成对电子,最内层有2个电子,根据构造原理可知,其电子排布式为:1s22s22p3或者1s22s22p63s23p3;
B、负一价离子的电子层结构与氩相同,其基态原子的核电荷数为18-1=17,据此分析;
C、正三价离子的3d能级为半充满,即离子的排布式为[Ar]3d5,据此分析;
D、某元素基态原子的M层全充满即排满18个电子,N层没有成对电子,只有一个未成对电子,则只有1个电子,据此分析.
解答 解:A、A元素基态原子的最外层有三个未成对电子,最内层有2个电子,根据构造原理可知,其电子排布式为:1s22s22p3或者1s22s22p63s23p3,所以元素符号可能为N或者P,故A错误;
B、负一价离子的电子层结构与氩相同,其基态原子的核电荷数为18-1=17,则基态原子价电子排布式为3s23p5,故B错误;
C、正三价离子的3d能级为半充满,即离子的排布式为[Ar]3d5,则基态原子排布式为[Ar]3d64s2,故C正确;
D、某元素基态原子的M层全充满即排满18个电子,N层没有成对电子,只有一个未成对电子,则只有1个电子,所以基态原子的电子排布式为[Ar]3d104s1,故D错误;故选:C.
点评 本题考查原子核外电子的排布规律以及构造原理的应用,以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质掌握程度,难度不大.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
10.将标准状况下的H2S气体通入100mL 5mol?L-1的CuSO4溶液中,再向混合溶液中滴加2mol?L-1NaOH溶液,当溶液的pH=7时,滴入的NaOH溶液体积为( )
| A. | 500mL | B. | 250mL | C. | 200mL | D. | 100mL |
17.已知可逆反应aA+bB?cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )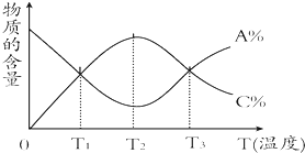

| A. | 该反应在T1、T3温度时达到化学平衡 | |
| B. | 该反应在T2温度时未达到化学平衡 | |
| C. | 升高温度,平衡会向正反应方向移动 | |
| D. | 该反应的正反应是放热反应 |
7.柴静的调查报告《苍穹之下》引起人们对雾霾的更大关注.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样,测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断试样的pH=4.
(2)洗涤含SO2的烟气,下列物质可作洗涤剂的是bc
a.CaCl2 溶液 b.Na2CO3 溶液 c.Ca(OH)2 悬浊液 d.浓H2SO4
(3)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:
2NO(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+N2(g);△H<0
①该反应平衡常数表达式K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$;温度升高K值减小(填“增大”或“减小”)
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是bd.
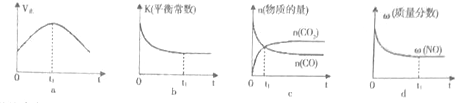
(4)汽车尾气中NOx和CO的生成及转化.
①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)△H>0,判断该设想能否实现:不能(填“能”或“不能”),简述其依据:;△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
(1)将PM2.5样本用蒸馏水处理制成待测试样,测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)洗涤含SO2的烟气,下列物质可作洗涤剂的是bc
a.CaCl2 溶液 b.Na2CO3 溶液 c.Ca(OH)2 悬浊液 d.浓H2SO4
(3)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:
2NO(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+N2(g);△H<0
①该反应平衡常数表达式K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$;温度升高K值减小(填“增大”或“减小”)
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是bd.

(4)汽车尾气中NOx和CO的生成及转化.
①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)△H>0,判断该设想能否实现:不能(填“能”或“不能”),简述其依据:;△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
14.将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 液态氧、干冰、硫酸、烧碱、氯化钠 | B. | 碘酒、冰、盐酸、烧碱、食盐 | ||
| C. | 氢气、二氧化硫、硝酸、纯碱、硝酸钾 | D. | 铜、硫酸钠、醋酸、石灰水、氯化铜 |
11.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、苯的同系物均不能使酸性KMnO4溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 芳香烃可以来自于煤干馏产品中的煤焦油 | |
| D. | 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同 |
12.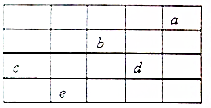 如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
 如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )| A. | b元素除0价外,只有一种化合价 | |
| B. | 五种元素中,c元素的天然氧化物可被称为刚玉 | |
| C. | b、d气态氢化物溶于水,溶液的酸性:b>d | |
| D. | c、d气态氢化物的稳定性:d>c |
 水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质:
水不仅是包括人类在内所有生命生存的重要资源,也是化学反应中的重要物质: