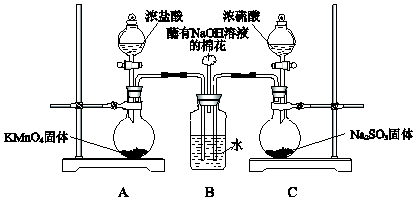
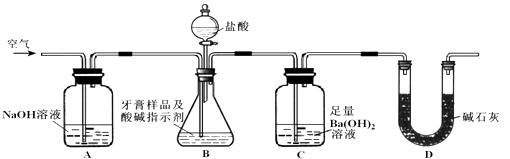
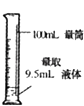
题目内容
【题目】在0.5L某NaCl溶液中含有0.5molNa+ , 对该溶液的说法不正确的是( )
A.配制100mL该溶液需用5.85g NaCl
B.该溶液的物质的量浓度为1molL ﹣1
C.该溶液中含有58.5g NaCl
D.量取100mL该溶液,其中Na+的物质的量为0.1mol
【答案】C
【解析】解:A.0.5L某NaCl溶液中含有0.5molNa+ , c(NaCl)= ![]() =1mol/L,则配制100mL该溶液需NaCl的质量为1mol/L×0.1L×58.5g/mol=5.85g,故A正确;
=1mol/L,则配制100mL该溶液需NaCl的质量为1mol/L×0.1L×58.5g/mol=5.85g,故A正确;
B.由选项A可知,该溶液的物质的量浓度为1molL ﹣1 , 故B正确;
C.含0.5molNa+ , 则NaCl的质量为0.5mol×58.5g/mol=29.25g,故C错误;
D.溶液具有均一性,则量取100mL该溶液,其中Na+的物质的量为0.1L×1mol/L=0.1mol,故D正确;
故选C.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目