题目内容
下列有关元素的性质及其递变规律正确的是( )
| A.IA族与ⅦA族元素间形成的化合物都是离子化合物 |
| B.第三周期元素从左到右,最高正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,其单质的氧化性越强 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |
B
解析试题分析:A.IA族与ⅦA族元素间形成的化合物可以是离子化合物,也可以是共价化合物,如HCl,所以错误;C.同主族元素的简单阴离子还原性越强,其单质的氧化性越弱,错误;D.同周期金属元素的化合价越高,其原子失电子能力越弱。
考点:元素的性质及其递变规律

练习册系列答案
相关题目
现有四种元素的基态原子的电子排布式如下 ①1s22s22p63s23p4 ②1s22s22p63s23p3; ③1s22s22p5下列正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.不成对电子数:③>②>① |
元素X形成的简单离子与钙离子的核外电子排布相同,且X的简单离子半径大于氯离子的半径,则X元素为
| A.Mg | B.S | C.Ar | D.K |
短周期元素W、X、Y和Z的原子序数依次增大,金属W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法正确的是
A.由金属W制备的高效电池可用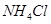 溶液作电解质 溶液作电解质 |
| B.元素Y、Z的最高价氧化物对应水化物之间可以发生反应 |
| C.元素X、Z形成的化合物为离子化合物 |
D.四种元素原子半径由大到小的顺序为: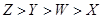 |
下列有关物质的性质或结构的说法正确的是( )
| A.L层上的电子数为奇数的原子一定是主族元素的原子 |
| B.周期表中的碱金属元素从上到下,其单质的还原性逐渐增强,熔沸点逐渐升高 |
| C.化学键的形成一定伴随着电子的转移和能量变化 |
| D.元素周期表中,位于金属和非金属分界线附近的元素属于过渡元素 |
据报道,科学家最近发现了一种新的粒子,这种粒子是由3个1 H原子核和2个电子构成。下列关于这种粒子的说法中,正确的是( )
| A.它是氢的一种新同位素 | B.这种新元素的核电荷数是3 |
| C.它是H2的一种新同素异形体 | D.它比一个普通氢分子多—个氢核 |
现有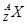 和
和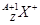 两种粒子,下列叙述正确的是
两种粒子,下列叙述正确的是
| A.质子数相等 |
| B.X元素的质量数为A |
C.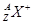 一定具有稀有气体元素原子的核外电子排布 一定具有稀有气体元素原子的核外电子排布 |
| D.它们的化学性质几乎完全相同 |
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元
素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是( )
| A.Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B.原子半径由大到小的顺序为:Z>Y> W |
| C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |