题目内容
现有四种元素的基态原子的电子排布式如下 ①1s22s22p63s23p4 ②1s22s22p63s23p3; ③1s22s22p5下列正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.不成对电子数:③>②>① |
A
解析试题分析:根据核外电子排布可知,①是S,②是P,③是F,A、非金属性越强,第一电离能越大。但由于P元素原子的3p轨道为半充满,稳定性强,电子能量较低,P元素的第一电离能大,即第一电离能F>P>S,A正确;B、同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径大小顺序是②>①>③,B不正确;C、非金属性越强,电负性越大,则电负性大小顺序是③>①>②,C不正确;D、根据核外电子排布式可知,不成对电子数:③>①>②,D不正确,答案选A。
考点:考查原子核外电子排布、元素电离能、电负性、原子半径等

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
右表为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是
| A.常温常压下,五种元素的单质中有两种是气态 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物比X的氢化物稳定 |
| D.Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者 |
下列图像表达正确的是
| A.等质量锌粉与足量盐酸反应 |
| B.氢气与氧气反应中的能量变化 |
| C.气态氢化物沸点 |
| D.催化反应与非催化反应过程中的能量关系 |
某一个元素质量数是51,中子数是28,其基态原子未成对电子数为
| A.4 | B.1 | C.2 | D.3 |
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是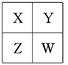
| A.W的原子序数可能是Y的原子序数的2倍 |
| B.Z元素的原子半径可能比Y元素的小 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的化学活泼性一定比X强 |
某同学在学习核外电子排布的知识时,把15P原子的电子排布式写成了1s22s22P63s23Px23Py1,他违背了
| A.能量守恒原理 | B.泡利不相容原理 | C.能量最低原则 | D.洪特规则 |
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
| A.W2-、X+ | B.X+、 Y3+ | C.Y3+、 Z2- | D.X+、 Z2- |
下列有关元素的性质及其递变规律正确的是( )
| A.IA族与ⅦA族元素间形成的化合物都是离子化合物 |
| B.第三周期元素从左到右,最高正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,其单质的氧化性越强 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |