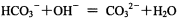题目内容
下列过程的离子方程式正确的是
| A.用烧碱溶液吸收Cl2:Cl2+2OH- =Cl-+ClO-+H2O |
| B.用饱和Na2CO3溶液转化锅垢中的CaSO4:CaSO4(s)+CO32- (aq)=CaCO3(s)+SO42-(aq) |
| C.实验室制备Fe(OH)3胶体:Fe3+ +3OH- =Fe(OH)3↓ |
| D.金属Na与水反应:Na +2H+ = H2↑+Na+ |
AB
试题分析:A、用烧碱溶液吸收Cl2生成钠盐和水,钠盐都是易溶强电解质,所以离子方程式书写正确;B、用饱和Na2CO3溶液转化锅垢中的CaSO4,碳酸钙的更难溶,属于沉淀的转化,正确;C、实验室制备Fe(OH)3胶体,是用饱和氯化铁在沸水中的水解,不是用铁盐与强碱的反应,错误;D、电荷不守恒,错误,答案选AB。

练习册系列答案
相关题目
 NH3↑+H2O
NH3↑+H2O