题目内容
钨是我国丰产元素。自然界中钨主要以钨(+6)酸盐的形式存在。黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4)。黑钨矿传统冶炼工艺流程图如下:

(1)已知上述转化中,除最后一步外,W的化合价未发生变化,则产品C的化学式为 ;如何将其冶炼成单质(用化学方程式表示): 。
根据金属的活动性不同,金属的冶炼方法一般有 三种。
(2)写出第一步转化中“Mn2+→MnO2”的离子方程式 。
(3)我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种蓝色的、非整比的钨的氧化物WO(3-x)。这种蓝色氧化钨具有比表面大、易还原的优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在正五价和正六价两种价态的钨,已知x的值为0.1,则蓝色氧化钨中这两种价态的钨原子数之比为 。

(1)已知上述转化中,除最后一步外,W的化合价未发生变化,则产品C的化学式为 ;如何将其冶炼成单质(用化学方程式表示): 。
根据金属的活动性不同,金属的冶炼方法一般有 三种。
(2)写出第一步转化中“Mn2+→MnO2”的离子方程式 。
(3)我国钨化学研究的奠基人顾翼东先生采用另外的反应制得了一种蓝色的、非整比的钨的氧化物WO(3-x)。这种蓝色氧化钨具有比表面大、易还原的优点。一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在正五价和正六价两种价态的钨,已知x的值为0.1,则蓝色氧化钨中这两种价态的钨原子数之比为 。
(1)WO3;WO3+3H2 W+3H2O;热分解法、热还原法、电解法
W+3H2O;热分解法、热还原法、电解法
(2)2Mn2++O2+4OH- 2MnO2+2H2O
2MnO2+2H2O
(3)1:4
 W+3H2O;热分解法、热还原法、电解法
W+3H2O;热分解法、热还原法、电解法(2)2Mn2++O2+4OH-
 2MnO2+2H2O
2MnO2+2H2O(3)1:4
(1)由工艺流程框图,可知MnO2、Fe2O3进入滤渣,滤液A中含Na+、WO42-,加入浓盐酸后沉淀为H2WO4,燃烧H2WO4得WO3,用氢气还原得W。(2)利用题中信息书写反应方程式:2Mn2++O2+4OH- 2MnO2+2H2O。(3)x=0.1,则钨的氧化物为WO2.9,可用十字交叉法求算:
2MnO2+2H2O。(3)x=0.1,则钨的氧化物为WO2.9,可用十字交叉法求算: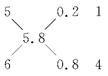 。
。
 2MnO2+2H2O。(3)x=0.1,则钨的氧化物为WO2.9,可用十字交叉法求算:
2MnO2+2H2O。(3)x=0.1,则钨的氧化物为WO2.9,可用十字交叉法求算: 。
。
练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
 Cu(OH)2+2H+
Cu(OH)2+2H+

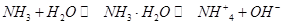
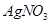 溶液中加入NaC1溶液后,再加Na2S溶液,白色沉淀转化为黑色沉淀:
溶液中加入NaC1溶液后,再加Na2S溶液,白色沉淀转化为黑色沉淀: =
=
 =
=
 Cl2↑ + H2↑ + 2OH-
Cl2↑ + H2↑ + 2OH- )中滴加NaHCO3溶液,放出无色气体:
)中滴加NaHCO3溶液,放出无色气体: