题目内容
下列关于常温下电解质溶液的叙述中,正确的是
A.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应: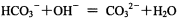 |
| B.向一定体积一定物质的量浓度的氨水中滴加盐酸,所得溶液一定存在:c(H+)+c(NH4+)=c(Cl?)+c(OH?) |
| C.标准状况下4.48L二氧化碳气体通入到2L0.15mol?L?1的NaOH溶液中,离子浓度大小顺序为:c(Na+) > c(CO32?) > c(OH?) >c(HCO3?) > c(H+) |
| D.pH=8的0.1 mol·L-l CH3COONa溶液中由水电离出的c(OH?)=1.0×10-8mol?L?1 |
B
试题分析:A、NaOH为足量,则OH?与碳酸氢铵溶液中的HCO3?、NH4+都发生反应,错误;B、不论氨水和盐酸量的多少,二者反应后的溶液一共含有4种离子:H+、NH4+、Cl?、OH?,根据电荷守恒可得关系式:c(H+)+c(NH4+)=c(Cl?)+c(OH?),正确;C、CO2的物质的量为0.2mol,NaOH的物质的量为0.3mol,发生两个反应:CO2+2NaOH=Na2CO3+H2O和CO2+NaOH=NaHCO3,根据化学方程式可得完全反应后生成的Na2CO3为0.1mol,NaHCO3为0.1mol,因为CO32?的水解程度大于HCO3?的水解程度,所以溶液中离子浓度大小顺序为:c(Na+) > c(HCO3?)> c(CO32?) > c(OH?) > > c(H+),错误;D、CH3COONa溶液中OH?来源于H2O的电离,因为pH=8,则c(OH?)=10-6mol?L?1,所以pH=8的0.1 mol·L-l CH3COONa溶液中由水电离出的c(OH?)=1.0×10-6mol?L?1,错误。

练习册系列答案
相关题目

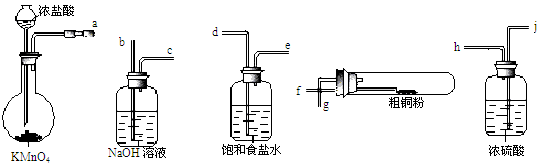
 CuCl42-(aq) + 4 H2O (l)
CuCl42-(aq) + 4 H2O (l)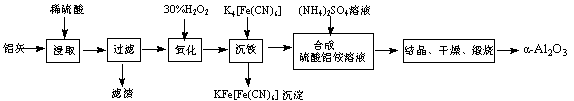
 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
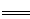 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O =BaSO4↓
=BaSO4↓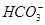 =CaCO3↓+
=CaCO3↓+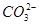 +2H2O
+2H2O