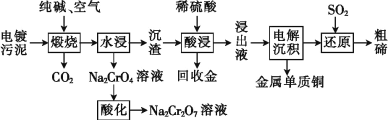
题目内容
【题目】卤代烯烃是合成塑料的重要原料,研究合成卤代烯烃具有重要意义。T℃时,在10 L的密闭容器中充入1mol 2-丁炔(CH3-C≡C-CH3,可用X表示)和1molHCl,以Al2O3为催化剂发生如下反应:
Ⅰ.CH3-C≡C-CH3(g)+HCl(g)![]()
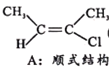 (g) H=akJ/mol(a<0)
(g) H=akJ/mol(a<0)
Ⅱ.CH3-C≡C-CH3(g)+HCl(g)![]()
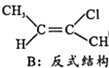 (g) H=bkJ/mol(a<0)
(g) H=bkJ/mol(a<0)
已知B比A更稳定,且产物A、B在混合物中的物质的量随时间变化如图所示。试回答下列问题。

(1)发生反应I、Ⅱ的同时,还有反应A转化为B,且焓变为△H'。则△H' ___0(填“>”、“<”或“=”)。
(2)①从反应开始至20 min时生成B的平均速率v(B)=____;
②反应至20 min时CH3-C≡C-CH3的转化率=____;
③在T℃时,反应I的平衡常数为____。
(3)T℃时,E1和E2分别代表反应I,Ⅱ的正反应活化能。
①由图得出:E1___E2(填“>”、“<”或“=”);
②试从反应方向的角度分析,20 min后A的物质的量减小的原因____
(4)其它条件相同时,测出生成A、B 的速率随温度变化如图所示,则提高B在较低温度下产率的措施是______

【答案】< 1×10-3mol/(Lmin) 60% 100 < B的能量低,A转化为B为放热反应,有利于A自发转化为B 加入低温下适合生成B的高性能催化剂
【解析】
(1)根据盖斯定律计算;
(2)①结合图示,根据v=![]() B的平均速率;
B的平均速率;
②反应I、Ⅱ都在发生,反应至20 min时,根据生成A、B的量根据反应推断CH3-C≡C-CH3的消耗量,转化率=![]() ×100%;
×100%;
③在T℃时,根据图像,根据平衡时各物质的量计算反应I的平衡常数;
(3)①结合图像,根据20min前产物A的量大于B分析;
②根据B比A更稳定,A转化为B为放热反应分析;
(4)其它条件相同时,相同温度下生成A、B 的速率不同,反应I、Ⅱ都使用催化剂,从催化剂的活性考虑提高B的生成速率的方法。
(1)已知:
Ⅰ.CH3-C≡C-CH3(g)+HCl(g)![]()
 (g) H=akJ/mol(a<0)
(g) H=akJ/mol(a<0)
Ⅱ.CH3-C≡C-CH3(g)+HCl(g)![]()
 (g) H=bkJ/mol(a<0)
(g) H=bkJ/mol(a<0)
根据盖斯定律,Ⅱ-Ⅰ可得
![]()
 △H'=(b-a) kJ/mol,已知B比A更稳定,则反应Ⅱ放出的热量比反应I多,故(b-a)<0,即△H'<0,反应放热;
△H'=(b-a) kJ/mol,已知B比A更稳定,则反应Ⅱ放出的热量比反应I多,故(b-a)<0,即△H'<0,反应放热;
(2)①结合图示,从反应开始至20 min时生成B的物质的量为0.2mol,根据v=![]() ,v(B)=
,v(B)=![]() =1×10-3mol/(Lmin);
=1×10-3mol/(Lmin);
②反应I、Ⅱ都在发生,反应至20 min时,根据图像,生成A、B的量分别为0.2mol、0.4mol,根据反应I、Ⅱ可得CH3-C≡C-CH3的消耗量为0.2mol+0.4mol=0.6mol,转化率=![]() ×100%=
×100%=![]() ×100%=60%;
×100%=60%;
③反应I的产物为A,在T℃时,根据图像,平衡时反应I生成A的物质的量为0.1mol,反应Ⅱ生成B的物质的量为0.8mol,则平衡时CH3-C≡C-CH3的物质的量为1mol-0.1mol-0.8=0.1mol,HCl的物质的量为1mol-0.1mol-0.8=0.1mol,反应I平衡常数K=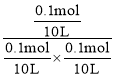 =100;
=100;
(3)①根据图像所示,20 min前,A的产量高于B,说明生成产物A的活化能较低,反应速率快,故E1<E2;
②根据B比A更稳定,说明B的能量低,A转化为B为放热反应,有利于A自发转化为B;
(4)相同温度下生成A、B 的速率不同,反应I、Ⅱ都使用催化剂,其它条件相同时,催化剂对反应I、Ⅱ生成A、B的催化效果不同,提高B在较低温度下产率的措施应为加入低温下适合生成B的高性能催化剂。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案【题目】砂质土壤分析中常用KarlFischer法是测定其中微量水含量,该方法原理是I2和SO2反应定量消耗水(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:________________________。
步骤①:消耗反应样品中的水
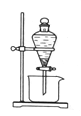
下图是某同学在实验室模拟KarlFischer法的实验装置图:
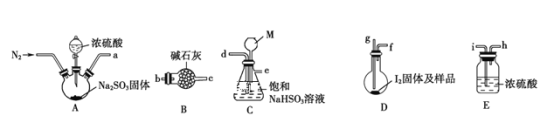
(2)装置连接的顺序为a__________(填接口字母顺序);M仪器的名称为__________,其在实验过程中的作用是__________________________。
(3)操作步骤①:连接装置并检查装置气密性,装入药品,_________________;关闭弹簧夹,打开分液漏斗活塞;反应结束后,关闭分液漏斗活塞,继续通入N2,取下D装置;步骤②:测定剩余的碘时,向反应后的D装置加入蒸馏水,过滤,充分洗涤滤渣,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余的碘单质,已知反应如下:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-。
+2I-。
(4)Na2S2O3标准液应装在________(填“酸式”“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是________________________________。
(5)滴定实验重复四次得到数据如下:
实验 | 1 | 2 | 3 | 4 |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00g土壤样品和10.16gI2(已知I2过量),则样品土壤中水的含量为________%(计算结果保留小数点后一位)。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将________(填“偏高”“偏低”或“不变”)。