题目内容
【题目】某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取 Na2Cr2O7 溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
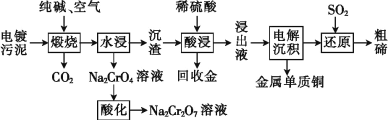
已知:煅烧时,Cu2Te 发生的反应为Cu2Te+2O2 ![]() 2CuO+TeO2。
2CuO+TeO2。
(1)煅烧时,Cr2O3 发生反应的化学方程式为______。
(2)浸出液中除了含有 TeOSO4(在电解过程中不反应)外,还可能含有_____(填化学式)。
(3)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
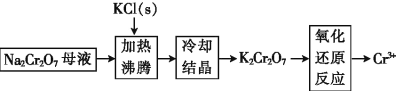
通过冷却结晶能析出大量 K2Cr2O7 的原因是_____。
(4)测定产品中 K2Cr2O7 含量的方法如下:称取产品试样 2.50 g 配成 250 mL 溶液,用移液管取出 25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用 0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2 标准液进行滴定,重复进行二次实验。(已知 Cr2 O72-被还原为 Cr3+)
①氧化还原滴定过程中的离子方程式为_____。
②若三次实验消耗(NH4)2Fe(SO4)2 标准液的平均体积为 25.00 mL,则所得产品中 K2Cr2O7 的纯度为_____%。[已知 M(K2Cr2O7)=294 g·mol-1,计算结果保留三位有效数字]。
(5)上述流程中 K2Cr2O7 发生氧化还原反应后所得溶液中除含有 Cr3+外,还含有一定浓度的 Fe3+杂质,可通过加碱调 pH 的方法使两者转化为沉淀。已知 c(Cr3+)=3×10-5 mol·L-1,则当溶液中开始析出 Cr(OH)3 沉淀时Fe3+是否沉淀完全______(填“是”或“否”),写出计算过程________________(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
【答案】2Cr2O3+3O2+4Na2CO3![]() 4Na2CrO4+4CO2 CuSO4 该条件下,K2Cr2O7 的溶解度比 Na2Cr2O7 小,且 K2Cr2O7 的溶解度随温度的降低而显著减小 Cr2O72- +6Fe2++14H+=2Cr3++6Fe3++7H2O 49.0 是 当溶液中开始析出Cr(OH)3沉淀时,c(OH-)=
4Na2CrO4+4CO2 CuSO4 该条件下,K2Cr2O7 的溶解度比 Na2Cr2O7 小,且 K2Cr2O7 的溶解度随温度的降低而显著减小 Cr2O72- +6Fe2++14H+=2Cr3++6Fe3++7H2O 49.0 是 当溶液中开始析出Cr(OH)3沉淀时,c(OH-)=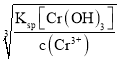 molL-1=
molL-1=![]() molL-1,则c(Fe3+)=
molL-1,则c(Fe3+)=![]() =
=![]() =2.0×10-12molL-1<1×10-5molL-1,说明Fe3+沉淀完全
=2.0×10-12molL-1<1×10-5molL-1,说明Fe3+沉淀完全
【解析】
某种电镀污泥中主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3) 以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜、粗碲等。根据流程图,煅烧时Cu2Te发生的反应为Cu2Te+2O2 ![]() 2CuO+TeO2,Cr2O3与纯碱和空气中的氧气反应生成Na2CrO4,Na2CrO4酸化后生成Na2Cr2O7溶液;沉渣中主要含有CuO、TeO2以及少量的金(Au),用稀硫酸溶解后,浸出液中主要含有铜离子和TeOSO4,电解后铜离子放电生成铜,溶液中含有TeOSO4,TeOSO4与二氧化硫发生氧化还原反应生成粗碲,据此分析解答。
2CuO+TeO2,Cr2O3与纯碱和空气中的氧气反应生成Na2CrO4,Na2CrO4酸化后生成Na2Cr2O7溶液;沉渣中主要含有CuO、TeO2以及少量的金(Au),用稀硫酸溶解后,浸出液中主要含有铜离子和TeOSO4,电解后铜离子放电生成铜,溶液中含有TeOSO4,TeOSO4与二氧化硫发生氧化还原反应生成粗碲,据此分析解答。
(1)煅烧时Cr2O3与纯碱和空气中的氧气反应生成Na2CrO4,反应的化学方程式为2Cr2O3+3O2+4Na2CO3 ![]() 4Na2CrO4+4CO2,故答案为:2Cr2O3+3O2+4Na2CO3
4Na2CrO4+4CO2,故答案为:2Cr2O3+3O2+4Na2CO3 ![]() 4Na2CrO4+4CO2;
4Na2CrO4+4CO2;
(2)根据上述分析,浸出液中除了含有TeOSO4(在电解过程中不反应)外,还有氧化铜与稀硫酸反应生成的硫酸铜(CuSO4)等,故答案为:CuSO4;
(3)在低温条件下K2Cr2O7的溶解度比 Na2Cr2O7 小,且K2Cr2O7的溶解度随温度的降低可能显著减小,因此通过冷却结晶可以析出大量K2Cr2O7,故答案为:在低温条件下K2Cr2O7的溶解度比 Na2Cr2O7 小,且K2Cr2O7的溶解度随温度的降低而显著减小;
(4)①氧化还原滴定过程中发生硫酸亚铁铵(NH4)2Fe(SO4)2与Cr2O72-的反应,其中Cr2O72-被还原为Cr3+,反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②n(Fe2+)=0.025L×0.1000molL-1=0.0025mol,根据方程式Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,则n(Cr2O72-)=0.0025mol×![]() ×
×![]() =
=![]() mol,则所得产品中K2Cr2O7的纯度为
mol,则所得产品中K2Cr2O7的纯度为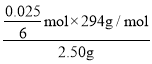 ×100%=49.0%,故答案为:49.0;
×100%=49.0%,故答案为:49.0;
(5)c(Cr3+)为3×10-5 molL-1,则当溶液中开始析出Cr(OH)3沉淀时,c(OH-)=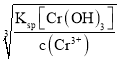 molL-1=
molL-1=![]() molL-1,则c(Fe3+)=
molL-1,则c(Fe3+)=![]() =
=![]() =2.0×10-12molL-1<1×10-5molL-1,说明Fe3+沉淀完全,故答案为:是;当溶液中开始析出Cr(OH)3沉淀时,c(OH-)=
=2.0×10-12molL-1<1×10-5molL-1,说明Fe3+沉淀完全,故答案为:是;当溶液中开始析出Cr(OH)3沉淀时,c(OH-)=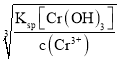 molL-1=
molL-1=![]() molL-1,则c(Fe3+)=
molL-1,则c(Fe3+)=![]() =
=![]() =2.0×10-12molL-1<1×10-5molL-1,说明Fe3+沉淀完全。
=2.0×10-12molL-1<1×10-5molL-1,说明Fe3+沉淀完全。

 名校课堂系列答案
名校课堂系列答案【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)
【题目】下列装置能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 探究Na2CO3和NaHCO3溶解度的相对大小 | 用已知浓度的NaOH溶液滴定未知浓度的稀硫酸 | 检验蔗糖与浓硫酸反应产生的CO2 | 验证镁和稀盐酸的反应的热效应 |
A. A B. B C. C D. D