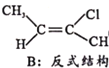
题目内容
【题目】砂质土壤分析中常用KarlFischer法是测定其中微量水含量,该方法原理是I2和SO2反应定量消耗水(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:________________________。
步骤①:消耗反应样品中的水
下图是某同学在实验室模拟KarlFischer法的实验装置图:
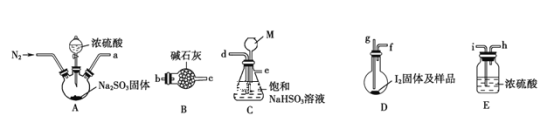
(2)装置连接的顺序为a__________(填接口字母顺序);M仪器的名称为__________,其在实验过程中的作用是__________________________。
(3)操作步骤①:连接装置并检查装置气密性,装入药品,_________________;关闭弹簧夹,打开分液漏斗活塞;反应结束后,关闭分液漏斗活塞,继续通入N2,取下D装置;步骤②:测定剩余的碘时,向反应后的D装置加入蒸馏水,过滤,充分洗涤滤渣,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余的碘单质,已知反应如下:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-。
+2I-。
(4)Na2S2O3标准液应装在________(填“酸式”“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是________________________________。
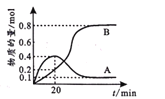
(5)滴定实验重复四次得到数据如下:
实验 | 1 | 2 | 3 | 4 |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00g土壤样品和10.16gI2(已知I2过量),则样品土壤中水的含量为________%(计算结果保留小数点后一位)。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将________(填“偏高”“偏低”或“不变”)。
【答案】SO2+I2+2H2O=H2SO4+2HI d→e→i→h→g→f→b→(c) 长颈漏斗 平衡内外气压,防止压强过大 打开弹簧夹,通入氮气 碱式 使所剩余的碘单质均进入滤液,测量结果更准确 7.2 偏低
【解析】
(1) I2、SO2、H2O发生反应,生成HI和H2SO4,化学反应方程式为SO2+I2+2H2O=H2SO4+2HI;
(2)装置A是制备二氧化硫气体,装置B中的碱石灰可以吸收尾气,并防止外界水蒸气加入装置,应该在整套装置的最后,D装置应该为二氧化硫与样品反应的装置,进入该装置的二氧化硫需要用浓硫酸(E)干燥,C装置为安全瓶,因此装置的连接顺序为ACEDB,接口顺序为d→e→i→h→g→f→b→(c);根据图示,M为长颈漏斗,在实验过程中,可以起到平衡内外气压,防止压强过大的作用。答案为:d→e→i→h→g→f→b→(c);长颈漏斗;平衡内外气压,防止压强过大;
(3)为了精准测定样品中的水含量,实验前,需通N2以排尽装置内的空气,所以需打开弹簧夹,通入氮气。答案为:打开弹簧夹,通入氮气;
(4)Na2S2O3水解显碱性,标准液应装在碱式滴定管中;因为洗涤液中也溶有一定量的碘,所以合并洗涤液和滤液的目的是使所剩余的碘单质均进入滤液,测量结果更准确。答案为:碱式;使所剩余的碘单质均进入滤液,测量结果更准确;
(5)①实验开始时,向D装置中加入10.00 g土壤样品和10.16 g I2(已知I2过量),n(I2)=![]() =0.04 mol,向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00 mL溶液,取25.00 mL 用0.20 mol·L-1 Na2S2O3标准液滴定剩余碘单质,根据实验数据可知,实验①的误差较大,删除该数值,②③④实验消耗Na2S2O3溶液的平均值=
=0.04 mol,向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00 mL溶液,取25.00 mL 用0.20 mol·L-1 Na2S2O3标准液滴定剩余碘单质,根据实验数据可知,实验①的误差较大,删除该数值,②③④实验消耗Na2S2O3溶液的平均值=![]() mL=20.00 mL,根据2S2O32-+I2=S4O62-+2I-,消耗碘单质物质的量=n(Na2S2O3)×
mL=20.00 mL,根据2S2O32-+I2=S4O62-+2I-,消耗碘单质物质的量=n(Na2S2O3)×![]() ×
×![]() =
=![]() ×0.020 0 L×0.20 mol·L-1×10=0.02 mol,即剩余I2物质的量=0.02 mol,从而得出与二氧化硫反应的碘单质物质的量=0.04 mol-0.02 mol=0.02 mol,消耗水为0.04 mol,土壤样品中水的含量=
×0.020 0 L×0.20 mol·L-1×10=0.02 mol,即剩余I2物质的量=0.02 mol,从而得出与二氧化硫反应的碘单质物质的量=0.04 mol-0.02 mol=0.02 mol,消耗水为0.04 mol,土壤样品中水的含量=![]() ×100%=7.2%。答案为:7.2;
×100%=7.2%。答案为:7.2;
②若Na2S2O3标准液已部分氧化变质,滴定过程中消耗的硫代硫酸钠溶液体积增大,测定剩余碘单质物质的量增大,则与二氧化硫反应的碘单质减少,反应的水的物质的量减小,计算得到水的含量偏低。答案为:偏低。

 阅读快车系列答案
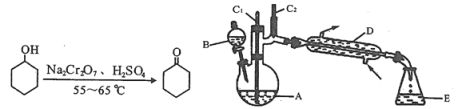
阅读快车系列答案【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)
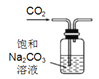
【题目】下列装置能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 探究Na2CO3和NaHCO3溶解度的相对大小 | 用已知浓度的NaOH溶液滴定未知浓度的稀硫酸 | 检验蔗糖与浓硫酸反应产生的CO2 | 验证镁和稀盐酸的反应的热效应 |
A. A B. B C. C D. D