题目内容
【题目】Ⅰ.(1)实验室常用石灰石与盐酸反应制取CO2,请写出该反应的离子方程式__________。
(2)实验室常用锌粒与稀硫酸制取氢气,请写出该反应的离子方程式__________。
Ⅱ.(1)实验室常将饱和三氯化铁溶液滴入沸水中继续加热至红褐色制备氢氧化铁胶体,请写出制备氢氧化铁胶体的化学方程式___________。
(2)将Fe(OH)3 胶体装入U形管内,用石墨做电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐加深,这表明Fe(OH)3胶体微粒带 _________ (填“正”或“负”)电荷。
(3)取少量Fe(OH)3 胶体于试管中,逐滴加入硫酸至过量,可看到的现象是____________。
(4)3.4gOH-中有_________mol OH-,其含有的电子数是_______个(阿伏加德罗常数用NA表示)。在同温同压下CH4和N2组成的混合气体对H2的相对密度为10,则混合气体中CH4与N2的体积比为_____。
【答案】CaCO3+2H+=Ca2++CO2↑+H2O H++Zn=H2↑+Zn2+ FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 正 先产生红褐色沉淀,接着沉淀又消失生成棕黄色溶液 0.2 2NA 2:1
Fe(OH)3(胶体)+3HCl 正 先产生红褐色沉淀,接着沉淀又消失生成棕黄色溶液 0.2 2NA 2:1
【解析】
Ⅰ.(1)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,据此书写;
(2)锌与稀硫酸反应生成硫酸锌和氢气,据此书写;
Ⅱ.(1)氯化铁与沸水反应生成氢氧化铁胶体,据此书写;
(2)根据氢氧化铁胶体能产生电泳现象分析判断;
(3)根据胶体可以发生聚沉以及氢氧化铁能与稀硫酸反应分析判断;
(4)根据m=nM、阿伏加德罗定律以及物质的组成分析计算。
Ⅰ.(1)实验室常用石灰石与盐酸反应制取CO2,该反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O。
(2)实验室常用锌粒与稀硫酸制取氢气,该反应的离子方程式为2H++Zn=H2↑+Zn2+。
Ⅱ.(1)实验室常将饱和三氯化铁溶液滴入沸水中继续加热至红褐色制备氢氧化铁胶体,制备氢氧化铁胶体的化学方程式为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
(2)将Fe(OH)3胶体装入U形管内,用石墨做电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐加深,这说明氢氧化铁的胶粒向阴极移动,则Fe(OH)3胶体微粒带正电荷。
(3)取少量Fe(OH)3胶体于试管中,逐滴加入硫酸至过量,开始胶体发生聚沉产生氢氧化铁沉淀,然后氢氧化铁和稀硫酸发生中和反应生成硫酸铁和水,所以可看到的现象是先产生红褐色沉淀,接着沉淀又消失生成棕黄色溶液。
(4)3.4gOH-中含有OH-的物质的量是3.4g÷17g/mol=0.2mol,1个氢氧根离子含有10个电子,则其中含有的电子数是2NA个。在同温同压下CH4和N2组成的混合气体对H2的相对密度为10,则根据阿伏加德罗定律可知混合气体的平均相对分子质量是10×2=20,所以依据十字交叉法可知混合气体中CH4与N2的体积比为(28-20)/(20-16)=2:1。

 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
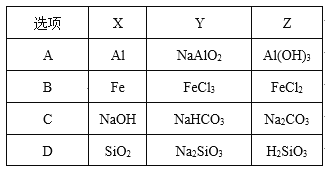
冲刺100分1号卷系列答案【题目】用如图装置研究电化学原理,下列分析中错误的是

选项 | 连接 | 电极材料 | 分析 | |
a | b | |||
A | K1K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
B | K1K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
C | K1K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
D | K1K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
A. A B. B C. C D. D
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是
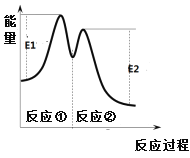
A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0