题目内容
20.几种短周期元素的原子半径及主要化合价如表:| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10 -10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | X、Z、M的最简单离子半径大小为X>M>Z | |
| B. | X、Z、R的最高价氧化物的水化物之间不可两两相互反应 | |
| C. | R的氢化物比Q的氢化物沸点高、更稳定 | |
| D. | Y的氢化物的水溶液可用于雕刻玻璃 |
分析 短周期元素,由元素的化合价可知,Q只有最低价-2价,则Q为O元素;Y元素有最高价+7,最低-1,故Y为Cl;R有+5、-3价,处于ⅤA族,原子半径小于Cl,且与O元素相近,与氧元素同周期,故R为N元素;X、M、Z的最高化合价分别为+1、+2、+3,没有负化合价,分别处于IA族、ⅡA族、ⅢA族,且原子半径X>M>Z>Cl,处于第三周期,故X为Na、M为Mg、Z为Al,结合元素单质化合物的性质及元素周期律进行解答.
解答 解:短周期元素,由元素的化合价可知,Q只有最低价-2价,则Q为O元素;Y元素有最高价+7,最低-1,故Y为Cl;R有+5、-3价,处于ⅤA族,原子半径小于Cl,且与O元素相近,与氧元素同周期,故R为N元素;X、M、Z的最高化合价分别为+1、+2、+3,没有负化合价,分别处于IA族、ⅡA族、ⅢA族,且原子半径X>M>Z>Cl,处于第三周期,故X为Na、M为Mg、Z为Al.
A.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径Na+>Mg2+>Al3+,故A正确;
B.X、Z、R的最高价氧化物的水化物分别为氢氧化钠、氢氧化铝、硝酸,两两之间可以相互反应,故B错误;
C.R的氢化物为氨气、Q的氢化物为水,常温下水为液态,氨气为气体,故水的沸点较高,氧元素非金属性强于氮元素,故水比氨气稳定,故C错误;
D.Y的氢化物的水溶液为盐酸,不能雕刻玻璃,用于雕刻玻璃的为氢氟酸,故D错误,
故选A.
点评 本题考查结构性质位置关系应用,难度不大,根据化合价及原子半径推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.将30mL 5mol/L NaOH溶液加水稀释到60mL,稀释后溶液中NaOH的物质的量为( )
| A. | 0.25mol | B. | 2.5mol | C. | 0.15mol | D. | 1.5mol |
12.下列离子方程式正确的是( )
| A. | 向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O-→2C6H5OH+CO32- | |
| C. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
9.某原电池的电池反应为:Fe+2Fe3+═3Fe2+,与此电池反应不符的原电池是( )
| A. | 铜片、铁片、FeCl3溶液组成的原电池 | |
| B. | 石墨、铁片、Fe(NO3)3溶液组成的原电池 | |
| C. | 银片、铁片、Fe(NO3)2溶液组成的原电池 | |
| D. | 铁片、铜片、Fe2(SO4)3溶液组成的原电池 |
10.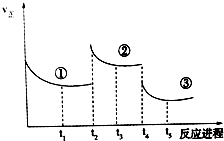 已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )
已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )
注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③
 已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )
已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )注:t1~t2、t3~t4、t5之后各时间段表示达到平衡状态①、②、③
| A. | t2~t3时间段,平衡向逆反应方向移动 | |
| B. | t4时刻改变的条件是减小压强 | |
| C. | 平衡状态①和②,SO2转化率相同 | |
| D. | 平衡状态①和②,平衡常数K值相同 |

 如图中,A是单质,B为淡黄色固体.写出下列转化的化学方程式:
如图中,A是单质,B为淡黄色固体.写出下列转化的化学方程式: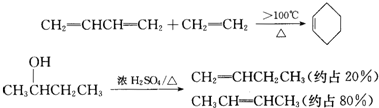

 ;C
;C ;D
;D .
.