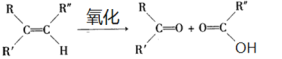
题目内容
【题目】氮化铝(AlN)是一种新型无机非金属材料。为测定某样品中AlN的含量,设计如下二种实验方案。(已知:样品中的杂质不与NaOH反应,且AlN+NaOH+3H2O═Na[Al(OH)4]+NH3↑)
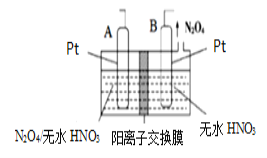
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
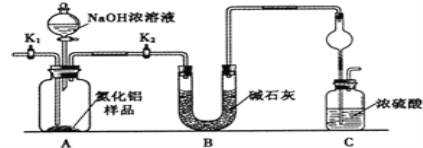
(1)如图C装置中球形干燥管的作用是______。
(2)完成以下实验步骤:组装好实验装置,首先______,再加入实验药品。接下来的实验操作是______,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见______。
(方案2)按以下步骤测定样品中AlN的纯度:
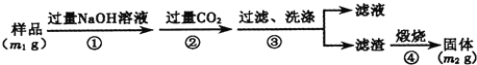
(4)步骤②生成沉淀的离子方程式为______。
(5)若在步骤③中未洗涤,测定结果将______(填“偏高”、“偏低”或“无影响”)。
(6)AlN的纯度为_____________(含m1,m2的式子表示)。
【答案】防止倒吸 检查装置气密性 关闭K1,打开K2 把装置中残留的氨气全部赶入C装置 C装置出口处连接一个干燥装置 2[Al(OH)4]-+CO2=HCO3-+Al(OH)3↓ 或CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓ 偏高 ![]() ×100%
×100%
【解析】
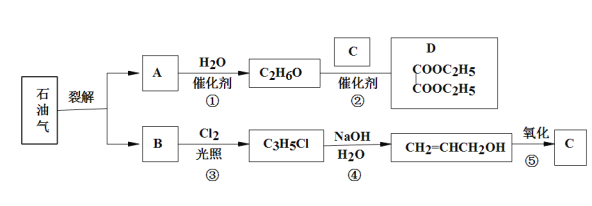
方案l:测定原理是通过测定AlN+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的质量来计算氮化铝的含量。
(1)氨气是能和浓硫酸发生反应的气体,结合装置分析;
(2)气体制备实验组装好实验装置,需要先检查装置气密性,再加入实验药品。实验时需要先关闭K1,打开K2;实验中需要将反应生成的氨气全部赶入装置C被浓硫酸吸收,便于准确测定装置C的增重;
(3)装置C中的浓硫酸也能够吸收空气中的水蒸气,据此分析解答;
方案2:根据流程可知,样品溶解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g;
(4)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢钠;
(5)步骤③中沉淀未洗涤,会造成氢氧化铝沉淀的质量偏高,铝元素的质量偏大,据此分析判断;
(6)测定AlN的纯度的原理是:AlN+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量。
方案1:测定原理是通过测定AlN+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的质量来计算氮化铝的含量。
(1)氨气与浓硫酸能发生反应,易发生倒吸,图C装置中球形干燥管可以防止倒吸,故答案为:防止倒吸;
(2)组装好实验装置,气体制备实验需要先检查装置气密性,再加入实验药品。接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气可以使反应生成的氨气全部赶入装置C中被浓硫酸吸收,故答案为:检查装置气密性;关闭K1,打开K2;把装置中残留的氨气全部赶入C装置;
(3)装置C中的浓硫酸也能够吸收空气中的水蒸气,使测定结果偏高,改进的方法可以是在C装置出口处连接一个盛碱石灰干燥管,故答案为:C装置出口处连接一个干燥装置;
方案2:流程分析可知,样品溶解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g;
(4)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成的,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(5)步骤③中沉淀未洗涤,会造成氢氧化铝沉淀的质量偏高,铝元素的质量偏大,根据质量守恒,则AlN的纯度偏高,故答案为:偏高;
(6)测定AlN的纯度的原理是:AlN+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量,Al2O3物质的量=![]() =
=![]() mol,依据氮元素守恒得到样品中氮元素物质的量=n(AlN)=
mol,依据氮元素守恒得到样品中氮元素物质的量=n(AlN)=![]() mol×2=
mol×2=![]() mol,A1N的纯度=
mol,A1N的纯度= ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

【题目】下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在一定条件下能与SiO2反应的有 ( )
A. ①②⑥ B. 全部 C. ①③④⑤ D. ②③⑥
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察____________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______色变成____________色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。