题目内容
【题目】标准状况下,往一定量的NaOH固体中,逐滴加入1.00 mol·L1NH4HSO4溶液充分反应,反应产生的NH3随NH4HSO4溶液体积的变化如图所示(假设生成的NH3全部逸出),请计算:
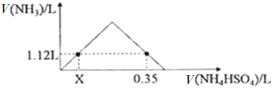
(1)X的值为______________。
(2)NaOH的物质的量为______________。
【答案】0.05L 0.40
【解析】
(1)发生的反应是2NaOH+NH4HSO4=NH3↑+2H2O+Na2SO4,加入X体积的NH4HSO4,NaOH有剩余,因此根据NH4HSO4进行计算,因此加入NH4HSO4的物质的量等于NH3的物质的量,即n(NH4HSO4)=![]() mol=0.05mol,X为0.05/1L=0.05L;(2)根据图像,加入0.35LNH4HSO4时,NaOH全部反应,有0.35molH+与OH-发生反应,0.05molNH4+与OH-发生反应,即NaOH的物质的量为(0.35+0.05)mol=0.40mol,即NaOH的物质的量为0.40mol。
mol=0.05mol,X为0.05/1L=0.05L;(2)根据图像,加入0.35LNH4HSO4时,NaOH全部反应,有0.35molH+与OH-发生反应,0.05molNH4+与OH-发生反应,即NaOH的物质的量为(0.35+0.05)mol=0.40mol,即NaOH的物质的量为0.40mol。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目