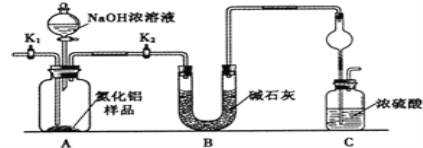
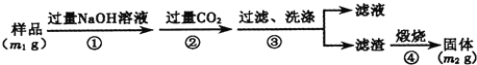
题目内容
【题目】石油是工业的血液,通过它可以得到很多重要的化工产品。
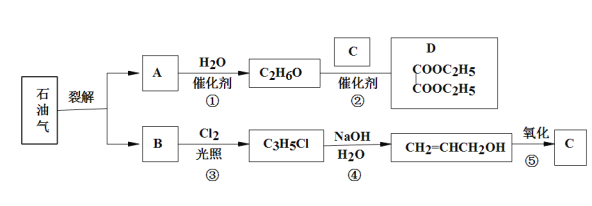
已知: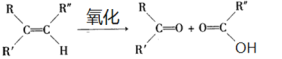
(1)B和A为同系物,B的结构简式为___________,其含有的官能团名称为__________;
(2)反应①的化学方程式为__________________________,其反应类型为______________;
(3)写出检验C3H5Cl中含有Cl原子的方法________________________________________;
(4)C的结构简式为_________________;
(5)反应④的化学方程式为____________________________________________________;
(6)设计一条由乙烯为原料制备D的合成路线(其他无机原料任选)______。合成路线流程图示例如下:![]() 。
。
【答案】CH2=CHCH3碳碳双键CH2=CH2+H2O→ CH3CH2OH加成反应加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl原子HOOC—COOHCH2=CHCH2Cl+NaOH → CH2=CHCH2OH +NaCl
【解析】
根据A与水在催化剂作用下反应生成分子式为C2H6O的物质可知为乙醇,则A为乙烯,乙醇与C在催化剂作用下发生酯化反应生成D为![]() ,可推出C为乙二酸;B与A为同系物,结合光照后产物分子中的碳原子数为3可知B为丙烯,光照条件下反应生成CH2ClCH=CH2,CH2ClCH=CH2在氢氧化钠的水溶液中加热发生水解反应生成HOCH2CH=CH2,HOCH2CH=CH2氧化生成C为乙二酸。
,可推出C为乙二酸;B与A为同系物,结合光照后产物分子中的碳原子数为3可知B为丙烯,光照条件下反应生成CH2ClCH=CH2,CH2ClCH=CH2在氢氧化钠的水溶液中加热发生水解反应生成HOCH2CH=CH2,HOCH2CH=CH2氧化生成C为乙二酸。
(1)B为丙烯,结构简式为CH2=CHCH3,其含有的官能团名称为碳碳双键;
(2)反应①是乙烯与水发生加成反应生成乙醇,反应的化学方程式为CH2=CH2+H2O → CH3CH2OH,其反应类型为加成反应;
(3)检验C3H5Cl中含有Cl原子的方法为加入氢氧化钠溶液,加热,冷却后加入稀硝酸中和,再加入硝酸银溶液,如果出现白色沉淀,证明有Cl原子;
(4)C为乙二酸,结构简式为HOOC—COOH;
(5)反应④是CH2ClCH=CH2在氢氧化钠的水溶液中加热发生水解反应生成HOCH2CH=CH2和氯化钠,反应的化学方程式为CH2=CHCH2Cl+NaOH→CH2=CHCH2OH +NaCl;
(6)乙烯与水发生加成反应生成乙醇;乙烯与溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷在氢氧化钠的水溶液中加热发生水解反应生成乙二醇,乙二醇氧化生成乙二酸,乙醇与乙二酸发生酯化反应生成乙二酸二乙酯。合成路线流程图如下:
 。
。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】向乙酸、乙醇、乙酸乙酯和水的平衡体系中加入少量含有18O的![]() ,达到新平衡后,体系中含有18O的物质是
,达到新平衡后,体系中含有18O的物质是
A. 乙酸、乙醇 B. 乙醇、乙酸乙酯
C. 乙醇、乙酸乙酯和水 D. 乙酸、乙醇、乙酸乙酯和水
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)若元素E的某种核素中中子数比质子数多3个,表示这种核素的符号为____________;
(2)把D的单质放到NaOH溶液中,反应的离子方程式为:_______________________;
(3)用电子式表示甲的形成过程:_____________________________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的质量比为________________;
(5)有100mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:____________mL。