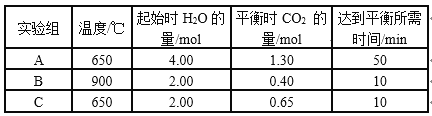
题目内容
【题目】氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,它们应用广泛。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为______________________________。
(2)N2O4可作火箭高能燃料N2H4的氧化剂。已知:2NO2(g)![]() N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压 × 物质的量分数[例如p(NO2)=p总×x(NO2)]。则反应2NO2(g)N2O4(g)△H=﹣akJmol﹣1平衡常数Kp表达式为______(用p总、和各气体物质的量分数x表示)。
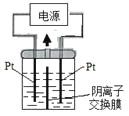
(4)新型绿色硝化剂N2O5可以通过N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的___极,电解池中生成N2O5的电极反应式为______________。

【答案】 NH4NO3![]() N2O↑+2H2O 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=﹣(c-a+2b)kJmol—1
N2O↑+2H2O 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=﹣(c-a+2b)kJmol—1  负 N2O4+2HNO3-2e-=2N2O5+2H+
负 N2O4+2HNO3-2e-=2N2O5+2H+
【解析】(1)NH4NO3在加热条件下分解产生N2O,根据原子守恒可知还有水生成,则此反应的化学方程式为NH4NO3![]() N2O↑+2H2O。
N2O↑+2H2O。
(2)已知:
①2NO2(g)![]() N2O4(g)△H=﹣akJmol﹣1;
N2O4(g)△H=﹣akJmol﹣1;
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;
③N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;
则根据盖斯定律可知②×2-①-③即得到气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-(c-a+2b)kJmol—1。
(3)反应2NO2(g)![]() N2O4(g)的平衡常数Kp表达式为
N2O4(g)的平衡常数Kp表达式为![]() =
= 。
。
(4)电极B产生N2O4,氮元素化合价降低,得到电子,是阴极,因此接直流电源的负极,电解池中生成N2O5的电极是阳极,其反应式为N2O4+2HNO3-2e-=2N2O5+2H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案